Noelle Bürgle, Dr. med. Silvia Khodaverdi, Prof. Dr. med. Christian Jackisch, Dr. med. Thomas Pierson, Dr. med. Kathrin Rosenkranz, Dr. med. Jens Kosse, Dr. med. Camillo Theo Müller*, Prof. Dr. med. Henrik Menke*
1. Einleitung
Die moderne Therapie des Mammakarzinoms hat sich zu einem Paradebeispiel der interdisziplinären Zusammenarbeit unter Miteinbeziehung der Wünsche und Erwartungen der betroffenen Patientinnen und Patienten entwickelt. Die aktuelle Evidenz lässt erkennen, dass der Erhalt der weiblichen Brust und/oder deren Rekonstruktion zu jedem Zeitpunkt das Überleben indikationsbezogen eher verbessert als verschlechtert. Somit sind die Anforderungen in den zertifizierten Brustkrebszentren von Beginn an auf die onkologische Sicherheit und den maximalen Erhalt des Körperbildes fokussiert. Hierzu gehört heute ebenso die frühzeitige Kenntnis über mögliche genetische Dispositionen bei familiär disponiertem Mamma- und/oder Ovarialkarzinom oder besonderen Subtypen, wie beispielsweise dem triple-negativen MaCa (TNBC).
Dieses Konzept haben wir über Jahre mit den Fachgesellschaften der Senologie und der Deutschen Krebsgesellschaft erarbeitet und etabliert und es in der S3-Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) etabliert. Somit haben die Patientinnen und Patienten bereits ab dem Diagnosezeitpunkt die optimale individualisierte Betreuung und Beratung durch die Ärztinnen und Ärzte, die sie im weiteren Verlauf betreuen werden und kennen das gesamte Therapiespektrum. Gerade die Beratung zur operativen Therapie und den unterschiedlichen Möglichkeiten der Brustrekonstruktion mit Implantaten oder Eigengewebe erfordert Zeit und Einfühlungsvermögen und ebenso die Einbindung der Strahlentherapeuten, wenn das onkologische Konzept eine Indikation zur Strahlentherapie vorsieht.
An eine rekonstruierte Brust sind klare Anforderungen zu stellen; sie muss sich aus Sicht der Betroffenen möglichst natürlich anfühlen. Es ist jedoch zu beachten, dass sich keine rekonstruierte Brust wie die ursprüngliche anfühlt. Weiterhin muss das rekonstruierte Gewebe oder Implantat für die bildgebende Nachsorge zugänglich sein, um Rezidive sicher zu erkennen.
Der interdisziplinäre Gedanke der Klinik für Gynäkologie und Geburtshilfe sowie der Klinik für Plastische Chirurgie am Sana Klinikum in Offenbach und die individuelle Beratung und Betreuung der Patientinnen mit einem Mammakarzinom für eine mögliche Rekonstruktion sind ein Garant für eine korrekte Entscheidungsfindung in einer häufig affektbeladen Situation und folgen dem Gedanken der partizipativen Entscheidungsfindung.
2. Case-Report
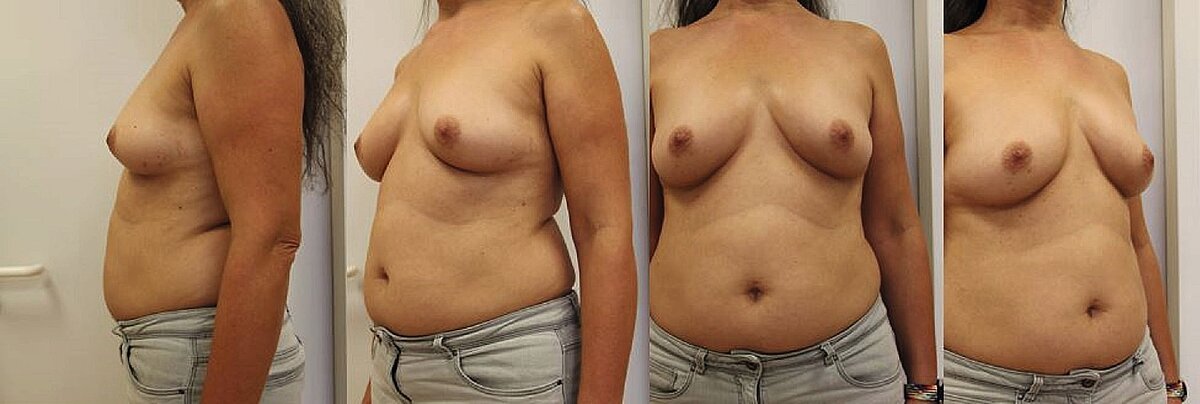
Eine 39-jährige, prämenopausale Patientin, bei der im Alter von 34 Jahren die Erstdiagnose eines multifokalen, mikropapillären Mammakarzinoms links gestellt wurde (Tumorstadium cT2 pN1 G3 cM0 ER IRS 2/10 %–50 % Her2neu-negativ Ki7 80 %).
Nach neoadjuvanter Chemotherapie bei funktionell triple negativer Immunhistologie mit 4 x EC 90/600mg/qm q2wks gefolgt von 12 x Paclitaxel weekly erfolgte eine tumoradaptierte Reduktionsplastik mit Axilladissektion links. Adjuvant erfolgten eine Radiatio links und die endokrine Therapie mit Tamoxifen 20mg/d geplant für zunächst fünf Jahre.
Unter der Therapie mit Tamoxifen kam es nach zwei Jahren zu einem ersten Inbrustrezidiv links – jetzt triple negativ (rpT1c(2) pNx G3 R0 L0 V0 cM0 ER IRS 0 / 0%, PR ER/PR. neg., Her2neu-negativ Score 0, Ki67 25 %), so dass nach Mastektomie eine Chemotherapie durchgeführt werden musste. Die Wahl fiel auf 6 x Carboplatin AUC 6 und Docetaxel 75 mg/qm. Nach weiteren zwei Jahren trat das zweite Rezidiv in Form von kutanen Metastasen an der Thoraxwand auf. Zudem traten suspekte axilläre Lymphknoten kontralateral und um den Aortenbogen auf, hierbei zeigte sich die Histologie unverändert mit negativem Hormonrezeptorstatus.
Der klinische Aspekt zeigte sich auf der Thoraxwand als Rötung und derbe Induration des Gewebes.
Nach Entscheidung der Tumorboardkonferenz wurde eine Chemotherapie mit nab-Paclitaxel 100 mg/qm und Bevazizumab 15 mg/kg begonnen. Im ersten Re-Staging zeigte sich ein gutes Ansprechen bzw. eine Partialremission mit regredienter Rötung der Thoraxwand und Größenregress der suspekten Lymphknoten axillär rechts und um den Aortenbogen. Zur Ergänzung der Diagnostik erfolgte eine Keimbahntestung, welche einen BRCAwt nachwies.
Nach wenigen Monaten zeigte sich der Befund an der Thoraxwand jedoch progredient mit einer Arrosion des Sternums sowie der 4. und 5. Rippe auf der linken Seite. Das Gewebe war wieder zunehmend gerötet und derb induriert. In der durchgeführten Diagnostik mittels CT Thorax/Abdomen fanden sich keine neuen Tumormanifestationen; persistierend waren die suspekten Lymphknoten rechts axillär und am Aortenbogen.
Aufgrund des ausgedehnten Befundes mit Fistelbildung und der daraus resultierenden Notwendigkeit der Therapieumstellung erfolgte zur optimalen Therapieplanung eine Vorstellung in der Tumorboardkonferenz mit inderdisziplinärem Diskurs u. a. zwischen Gynäkologen, Hämatoonkologen sowie den Kollegen der plastischen und Thoraxchirurgie.
Es fiel die Entscheidung zur operativen Therapielösung, da eine Systemtherapie aktuell durch die Fistelbildung mit Sondierung bis zum knöchernen Thorax als nicht durchführbar gewertet wurde.
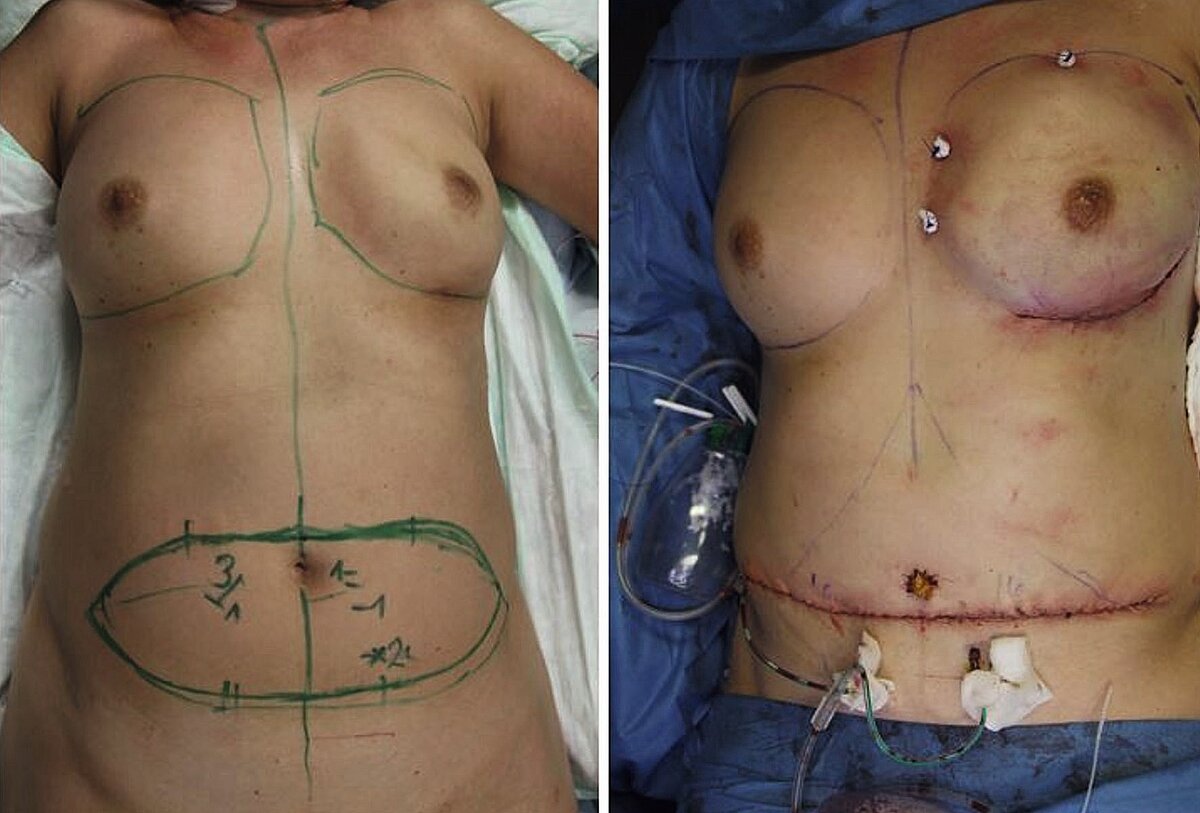
Zunächst erfolgte in einer ersten OP durch die Gynäkologen und Thoraxchirurgen im Bereich der Fistel eine Thoraxwandresektion mit partieller Resektion der 4.–6. Rippe und des linken Hemisternums und Implantation eines Parietex Composite Netzes und Vacuseal Anlage.
Nach mehrmaligen Verbandswechseln der VAC und Nachresektionen konnte eine R0-Resektion erreicht werden. Dadurch konnte die Defektdeckung geplant und die Patientin zur weiteren Behandlung in die Klinik der plastischen Chirurgen übernommen werden.
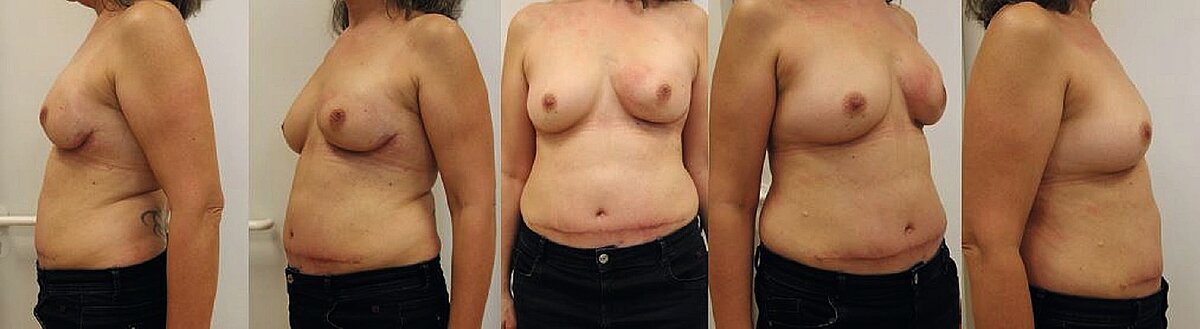
Es erfolgten eine Deckung an der Thoraxwand sowie Brustaufbau links mittels einer gestielten, kontralateralen TRAM-Lappenplastik (Transverse rectus abdominis myocutaneus-Lappenplastik).
Nach Abschluss der Wundheilung konnte anschließend die 2nd-line Therapie mit Sacituzumab-Govitecan begonnen werden, unter welcher die Patientin aktuell rezidiv frei ist.
3. Definition und Psychologie
Die interdisziplinäre Zusammenarbeit von Gynäkologen und plastischen Chirurgen bei Brustkrebspatientinnen ist entscheidend für eine ganzheitliche medizinische Behandlung. Während der gesamten ärztlichen Betreuung gilt es, den Patientinnen einen Fahrplan mit allen möglichen Therapiekonzepten und anschließendem rekonstruktiv-operativem Abschluss vorzustellen. Somit kann eine optimale, individuelle Entscheidung im Austausch beider Abteilungen und der Patientin getroffen werden.
In interdisziplinärer Abstimmung können beide Fachgebiete sicherstellen, dass durch eine enge Kooperation eine nahtlose Integration aus Tumorchirurgie und systemischer Therapie sowie plastischer Rekonstruktion geplant wird. Durch dieses Konzept kann das Ziel einer optimalen onkologischen, als auch rekonstruktiv-ästhetischen Behandlung mit erhöhter Patientenzufriedenheit und Sicherheit gewährleistet werden.
Die Auswirkungen der Diagnose eines Malignoms und der resultierenden onkologisch erforderlichen Tumorbehandlung (inklusive Operation, Radiatio und Chemotherapie) auf die Psyche der Patientinnen – einhergehend mit der optischen Veränderung des Körpers – sind enorm. Der Verlust einer Brust kann tiefgreifende psychologische Auswirkungen haben, welche häufig mit Depressionen und gemindertem Selbstbewusstsein einhergehen. Um die komplette interdisziplinäre Therapie anzubieten, ist eine begleitende psychoonkologische Betreuung jeder Patientin anzubieten und in Erwägung zu ziehen.
Erfahren Patientinnen schon vor der gesamten Behandlung die Möglichkeiten des symmetrischen Brustaufbaus, so gibt es von Beginn eine Aussicht auf eine Rückkehr in die „Normalität“. Studien belegen, dass die Lebensqualität nach einer chirurgischen Rekonstruktion erhöht ist. Daher ist die Erstellung eines multimodalen, interdisziplinären Fahrplans mit Einbeziehung mehrerer Fachgebiete entscheidend für das medizinische als auch psychische Outcome der Patientin.
4. Planung
Der Erstkontakt mit der Patientin erfolgt in der Regel über die Brustsprechstunde, in die sie vom niedergelassenen Gynäkologen/Gynäkologin überwiesen wurde. Zunächst wird die Anamnese der Patientin erhoben, wobei es darum geht, wie der Befund in der Brust aufgefallen ist, zum Beispiel als Tastbefund, Hauteinziehung, Größendifferenz oder Hautveränderung. Ebenso wird die Familienanamnese bezüglich bestehender Brustkrebs- und/oder Eierstockkrebserkrankungen erfragt.
Danach erfolgt die klinische Untersuchung mittels Inspektion und Palpation sowie die Durchführung einer Mammasonographie einschließlich der Lymphabflusswege. Ergänzend erhält die Patientin eine Mammographie beidseits. Um die lokoregionäre Ausbreitungsdiagnostik zu optimieren und die therapeutische Entscheidungsfindung zu verbessern, kann in einzelnen Fällen eine ergänzende Mamma-MRT Untersuchung sinnvoll sein, auch wenn die Kosten nicht zwingend von der GKV übernommen werden.
Hierzu zählen zum Beispiel eine unklare lokoregionäre Ausbreitung nach der konventionellen Diagnostik, das Vorliegen eines lobulären Karzinoms, ein hohes genetisches bzw. familiäres Erkrankungsrisiko sowie junge, prämenopausale Patientinnen.
Je nach Darstellbarkeit des auffälligen Befundes in der Brust und ggfs. in der Axilla erhält die Patientin zur Diagnosesicherung entweder eine sonographisch gesteuerte Biopsie, eine stereotaktische Vakuumbiopsie (bei Vorliegen von Mikrokalk ohne begleitenden Herdbefund) oder in begründeten Ausnahmefällen eine offene Exzisionsbiopsie. Durch geeignete Maßnahmen (zum Beispiel durch eine Clipeinlage), soll der Untersucher/Untersucherin sicherstellen, dass die Lokalisation des Befundes wiederzufinden ist.
Anhand der Tumorbiologie (Grading, Her2-Status, Hormonrezeptorstatus, Ki 67) sowie des Nodalstatus und der Befundgröße/Ausdehnung des Befundes in Relation zur Brustgröße wird nun entschieden, ob eine primär systemische Chemotherapie oder eine primär operative Therapie erfolgen wird.
Die Durchführung von Staginguntersuchungen (CT Thorax/Abdomen und Skelettszintigraphie) erfolgt bei Patientinnen mit erhöhtem Metastasierungsrisiko (Nodal-positiv, Tumorgröße > 2 cm) und/oder aggressiver Tumorbiologie (positiver Her2-Status, TNBC), symptomatischer Patientin oder bei geplanter systemischer Therapie.
Bei hormonrezeptorpositiven, Her2-negativen Tumoren können zudem sogenannte Genexpressionstests eingesetzt werden, um das Rückfallrisiko und somit die Prognose der Patientin individuell abzuschätzen, wodurch eine unnötige Chemotherapie vermieden werden kann.
Bei ausgedehnten Befunden mit schlechter Relation zur Brustgröße, kann eine subkutane Mastektomie mit anschließendem Wiederaufbau der Brust notwendig werden. In diesen Fällen wird die Patientin vor der geplanten primär systemischen Therapie oder der primär operativen Therapie in der onkoplastischen Sprechstunde vorgestellt.
5. Die optimale Entscheidungsfindung – sechs Faktoren
In der onkoplastischen Sprechstunde, in der komplexe Entscheidungen zur Behandlung von Brustkrebspatientinnen getroffen werden, spielt die sog. Entscheidungsoptimierung eine zentrale Rolle. Diese Prinzipien dienen dazu, den Entscheidungsprozess zu optimieren, indem systematische Verzerrungen und zufällige Schwankungen, auch als „Lärm“ bezeichnet, minimiert werden. Die sechs Prinzipien der Entscheidungsoptimierung und ihre Anwendung in der Sprechstunde lassen sich wie folgt beschreiben:
- Prozessstandardisierung: Einheitliche Protokolle und Checklisten sorgen dafür, dass alle relevanten Aspekte einer Behandlung strukturiert berücksichtigt werden. Dies reduziert die Variabilität zwischen verschiedenen Ärzten und Konsultationen und führt zu konsistenteren Entscheidungen.
- Trennung von Information und Bewertung: Zuerst werden die medizinischen Daten, einschließlich Befunden und Bildgebungsergebnissen, sorgfältig gesammelt und dokumentiert, bevor eine Diskussion über mögliche Therapieansätze stattfindet. Dadurch werden voreilige Schlüsse oder persönliche Vorurteile bei der Entscheidungsfindung vermieden.
- Interdisziplinäre Zusammenarbeit: Die Einbindung von Experten unterschiedlicher Fachrichtungen wie Chirurgie, Onkologie und Radiologie trägt dazu bei, den Entscheidungsprozess zu bereichern. Verschiedene Perspektiven garantieren eine umfassende, ausgewogene Entscheidung, die alle Aspekte der Behandlung berücksichtigt.
- Förderung unabhängiger Beurteilungen: Um Gruppendruck und Verzerrungen zu vermeiden, werden die Meinungen der beteiligten Fachärzte zunächst unabhängig voneinander eingeholt. Erst danach erfolgt eine gemeinsame Besprechung. So wird sichergestellt, dass alle Perspektiven unvoreingenommen in die Entscheidung einfließen.
- Feedback und kontinuierliche Kalibrierung: Regelmäßiges Feedback zu getroffenen Entscheidungen sowie deren Behandlungsergebnissen trägt dazu bei, die Entscheidungsqualität zu steigern. Fallbesprechungen und Nachverfolgungen der Therapieergebnisse helfen, die Genauigkeit und Zuverlässigkeit künftiger Entscheidungen zu verbessern.
- Sensibilisierung für Entscheidungsstörfaktoren: Es ist wichtig, dass sich die Entscheidungsträger der potenziellen Einflussfaktoren bewusst sind, die zu inkonsistenten Urteilen führen können. Durch regelmäßige Schulungen und Sensibilisierungen können Ärzte lernen, den „Lärm“ in ihren Entscheidungen zu erkennen und dessen Einfluss zu reduzieren.
Fazit
Die konsequente Anwendung dieser sechs Prinzipien der Entscheidungsoptimierung in der onkoplastischen Sprechstunde ermöglicht fundiertere und verlässlichere Entscheidungen. Dies führt nicht nur zu einer verbesserten medizinischen Versorgung, sondern auch zu einem gesteigerten Vertrauen und einer höheren Zufriedenheit bei den Patientinnen.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Die onkoplastische Sprechstunde“ von Dr. med. Camillo Theo Müller und Prof. Dr. med. Henrik Menke et al. finden Sie im Portal sowie in der PDF-Version dieses Artikels.
Die Teilnahme zur Erlangung von Fortbildungspunkten ist nur online über das Portal vom 25.02.2025 bis 24.08.2025 möglich. Die Fortbildung ist mit drei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autorin sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring und es bestehen keine Interessenkonflikte. (red)
Noelle Bürgle1, Dr. med. Silvia Khodaverdi2, 3,Prof. Dr. med. Christian Jackisch5, Dr. med. Thomas Pierson1, 4,Dr. med. Kathrin Rosenkranz2, 3, Dr. med. Jens Kosse6, Dr. med. Camillo Theo Müller1, 2*,Prof. Dr. med. Henrik Menke1, 2*
1 Plastische Chirurgie, Chirurgie III; 2 Brustzentrum; 3 Klinik für Gynäkologie und Geburtshilfe, Sana Klinikum Offenbach; Goethe-Universität Frankfurt 4 G & P Ästhetik, Röntgenstr. 9, 60388 Frankfurt am Main; 5 Kliniken Essen Mitte, Essen; 6 Klinik für Gynäkologie und Geburtshilfe am Klinikum Hanau
* Geteilte Letztautorenschaft, gleicher Beitrag von beiden Autoren
Korrespondenzadresse:
Dr. med. Camillo Müller
Goethe-Universität Frankfurt
E-Mail: camillo.mueller@hin.ch