Dr. med. Cristina Cano Garcia, Dr. med. Clara Humke, Dr. med. Benedikt Höh, Dr. med. Mike Wenzel, Prof. Dr. med. Philipp Mandel, Prof. Dr. med. Felix K. H. Chun
Einleitung
Das Prostatakarzinom zählt weltweit zu den häufigsten Krebsarten bei Männern. In Deutschland wurden im Jahr 2018 65.200 neue Fälle diagnostiziert und war die Krebsart mit der höchsten Inzidenzrate [1-3]. Mit 14.963 Todesfällen war es zudem die zweithäufigste Krebstodesursache. Das durchschnittliche Erkrankungsalter beträgt 71 Jahre, mit einem Lebenszeitrisiko von 12,1 %. Das Erkrankungsrisiko steigt mit zunehmendem Alter, von weniger als 0,1 % für einen 35-jährigen Mann bis etwa 6 % für einen 75-jährigen Mann [3]. Trotz der hohen Inzidenz weist das Prostatakarzinom insgesamt eine gute Prognose auf, mit einer relativen 5-Jahres-Überlebensrate von 89 % und einer relativen 10-Jahres-Überlebensrate von 88 % [5]. Eine Heilung ist jedoch nur im nicht-metastasierten Stadium möglich [4-6]. Angesichts des demografischen Wandels ist es für die Urologie entscheidend, klinisch-relevante Prostatakarzinome frühzeitig zu erkennen und Behandlungsoptionen sorgfältig abzuwägen, um optimale onkologische Ergebnisse zu erzielen und gleichzeitig die Lebensqualität der Patienten zu erhalten. Neue diagnostische Methoden wie die multiparametrische Magnetresonanztomographie (mpMRT) für die Identifikation von klinisch-signifikanten Prostatakarzinomen und die Prostataspezifisches Membranantigen Positronenemissionstomographie/Computertomographie (PSMA-PET/CT) für die bessere Detektion von Metastasen bei Hochrisikokarzinomen haben Einzug in nationale und internationale Leitlinien gehalten [4–6]. Weiterhin wurden neue Operations- und Bestrahlungstechniken zur kontinuierlichen Verbesserung der funktionellen Ergebnisse entwickelt.
In dem folgenden Beitrag werden wir die Prostatakarzinom-Früherkennung, die Diagnostik, die aktuellen Behandlungsmöglichkeiten sowie die Rehabilitation und die Nachsorge für Patienten mit lokalisierten und lokal fortgeschrittenem Prostatakarzinom erläutern.
Prostatakarzinomfrüherkennung
Die gesetzliche Prostatakarzinomfrüherkennung in Deutschland gilt ab dem 45. Lebensjahr. Männer mit einer positiven Familienanamnese bezüglich der Häufung von Prostatakarzinomfällen (Vater und/oder Brüder) haben ein über zweifach erhöhtes Risiko [5]. In diesem Fall kann die Altersgrenze für die gesetzliche Früherkennung auf 40 Jahre heruntergesetzt werden. Teil der gesetzlichen Prostatakarzinom-Früherkennung ist die körperliche Untersuchung einschließlich der digital-rektalen Untersuchung (DRU). Gemäß der aktuellen deutschen S3-Leitlinie Prostatakarzinom wird die alleinige DRU jedoch als nicht geeignet für die Früherkennung angesehen [5]. Als weitere Untersuchung kann die Bestimmung des Prostata-spezifischen Antigens (PSA) erfolgen. Die PSA-Wert-Bestimmung im Rahmen der Früherkennung wird kontrovers diskutiert. Ein erhöhter PSA-Wert kann auf das Risiko eines Prostatakarzinoms hinweisen. Jedoch ist das PSA ein organspezifischer und kein tumorspezifischer Marker. Verschiedene Faktoren können den PSA-Wert beeinflussen, darunter das Prostatavolumen, Entzündungen im Sinne einer Prostatitis oder eines Harnwegsinfekts, Harnverhalte, vorherige Manipulation der Prostata (z. B. durch rektale Untersuchung, transrektaler Ultraschall, Katheterismus, Sexualpraktiken) oder bestimmte Medikamente (z. B. durch 5-alpha-Reduktasehemmer). Auch muss ein erhöhter PSA-Wert unter Berücksichtigung der zuvor genannten Einflussfaktoren kontrolliert werden. In Deutschland ist der PSA-Test nicht in der gesetzlichen Früherkennung enthalten und wird als individuelle Gesundheitsleistung (IGeL) angeboten. Im Jahr 2020 lehnte der Gemeinsame Bundesausschuss (G-BA) in Deutschland die Integration des PSA-Tests in die gesetzliche Prostatakrebsfrüherkennung, basierend auf einer Überprüfung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG), ab [7, 8]. Der G-BA-Beschluss argumentiert, dass der Nutzen des PSA-Screenings die Schäden für Männer nicht aufwiege, insbesondere aufgrund hoher Raten von Überdiagnosen und falsch positiven Befunden. Kritikpunkte sind Überdiagnostik, Übertherapie und mögliche psychische Belastungen. Die Deutsche Gesellschaft für Urologie (DGU) kritisierte diesen Beschluss und spricht sich für eine PSA-gestützte Früherkennung als risikoadaptierte, individualisierte Strategie aus [9]. Dabei sollten das Patientenalter, bestehende Erkrankungen, die Lebenserwartung und Patientenpräferenzen in die Entscheidung zur PSA-Testung einbezogen werden. In den Vereinigten Staaten empfahl die US Preventive Services Task Force (USPSTF) 2008, auf das PSA-Screening bei Männern über 75 Jahren zu verzichten, und erweiterte diese Empfehlung im Jahr 2012 auf alle Altersgruppen. In den folgenden Jahren wurde ein Anstieg der Prostatakarzinompatienten mit einem hohen oder sehr hohen Risikoprofil sowie eine Zunahme von Patienten mit metastasiertem Prostatakarzinom registriert [10–12]. Im Mai 2018 erfolgte eine weitere Anpassung, die Männer im Alter von 55 bis 69 Jahren ermutigte, nach einer Aufklärung mit ihrem Arzt eine individuelle Entscheidung über die PSA-gestützte Früherkennung zu treffen [13]. Eine retrospektive Analyse aus Daten der Veteran Health Administration (VHA) mit 4,68 Millionen Männer 2005 und 5,37 Millionen Männer 2019 bewertete drei Jahre ein jährliches PSA-Screening versus kein Screening. Das Inzidenzverhältnis für metastasiertes Prostatakarzinom lag bei 1,11 pro 10 % Anstieg der Nicht-Screening-Rate [12]. Die Langzeitauswirkungen dieser Anpassung auf den zuvor beobachteten Trend in den USA bleiben somit weiter abzuwarten.
Diagnostik
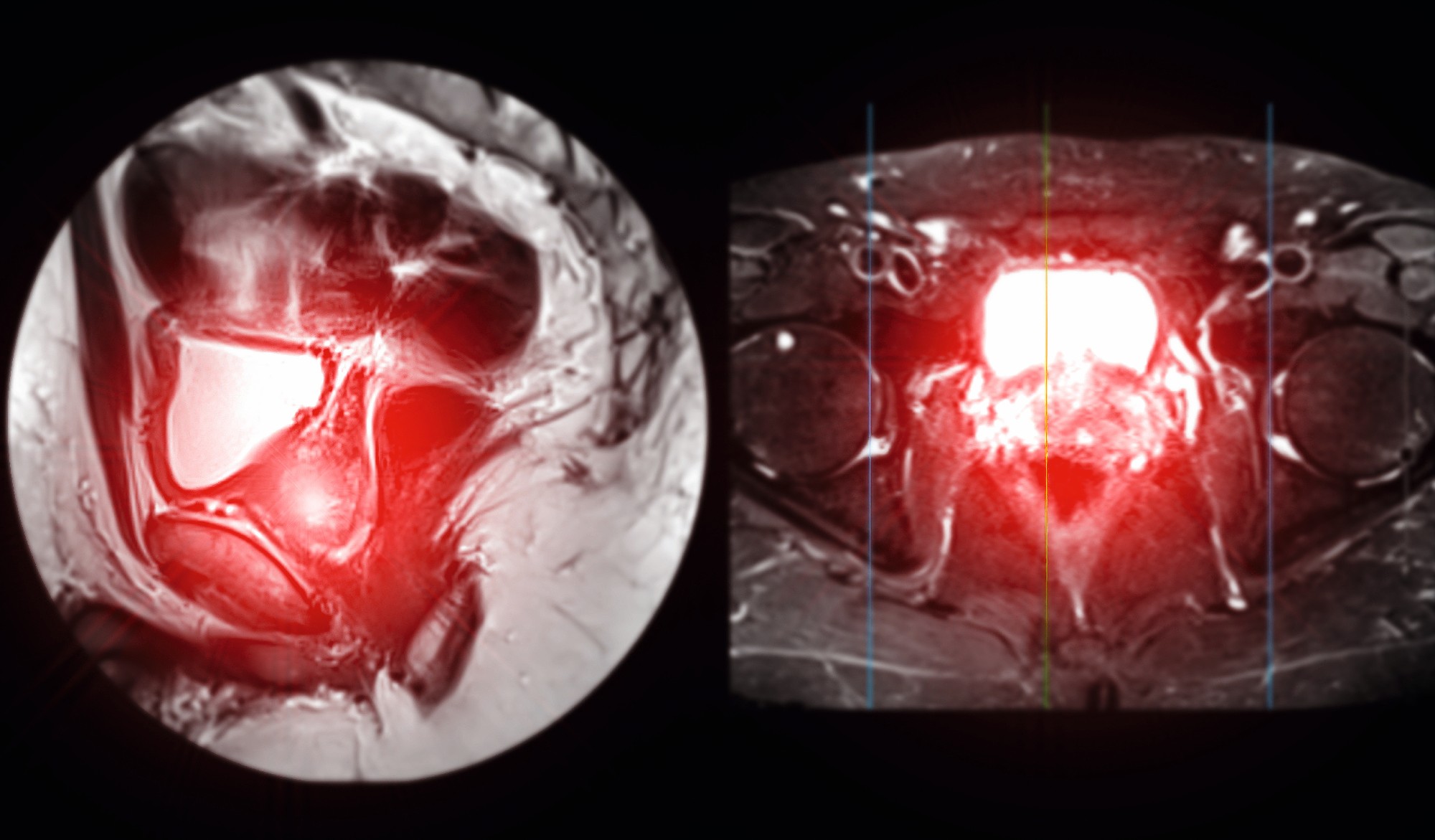
Besteht nach der DRU und PSA-Testung der Verdacht eines Prostatakarzinoms, sollte eine weitere Untersuchung mittels mpMRT und ggf. einer Prostatastanzbiopsie erfolgen [5]. Zur standardisierten Auswertung der mpMRT der Prostata und somit zur Detektion und Einschätzung des Malignitätsrisikos von Prostataveränderungen wird die sogenannte PI-RADS-Klassifikation (Prostate Imaging Reporting and Data System) verwendet [14]. Die PI-RADS-Klassifikation besteht aus einer Skala von 1 bis 5, wobei jeder PI-RADS-Wert ein bestimmtes Wahrscheinlichkeitsniveau für das Vorliegen eines Prostatakarzinoms beschreibt. PI-RADS 1 und 2 stehen hier für ein sehr niedriges bzw. niedriges Malignitätsrisiko, wobei PI-RADS 3, 4 und 5 für ein mittleres, hohes oder sehr hohes Malignitätsrisiko sprechen. Somit spricht man ab einer PI-RADS 3 Läsion in der mpMRT von einem auffälligen Befund und eine Prostatastanzbiopsie wird empfohlen [5]. Bei der Prostatastanzbiopsie handelt es sich um eine gesteuerte Biopsie mittels transrektalem Ultraschalls (TRUS). Traditionell wurden die Prostatastanzen transrektal entnommen. Die aktuelle Leitlinie der Europäischen Gesellschaft für Urologie – European Association of Urology (EAU) empfiehlt jedoch zur Senkung des Infektionsrisikos die perineale Prostatastanzbiopsie [4]. Weiterhin wird laut deutscher S3-Leitlinie Prostatakarzinom eine systematische Prostatastanzbiopsie in Kombination mit einer mpMRT-Zielbiopsie empfohlen [5]. Bei der systematischen Prostatastanzbiopsie werden in der Regel zehn bis zwölf Gewebezylinder entnommen. Bei der mpMRT-Zielbiopsie werden die Bilder der mpMRT und des TRUS fusioniert und die vorher definierten PI-RADS Läsionen mit jeweils im Durchschnitt 2–3 Stanzzylindern biopsiert. Wichtige Studien wie die PRECISION-Studie (Prostate Evaluation for Clinically Important Disease: Sampling Using Image Guidance or Not?) und die PROMISE-Studie (PROstate Magnetic resonance Imaging Study) zeigen, dass die Durchführung der mpMRT die Anzahl der notwendigen Prostatastanzbiopsien und somit einer invasiven Diagnostik reduziert und die Detektionsraten von klinisch- signifikanten Prostatakarzinomen durch die mpMRT-Zielbiopsie erhöht [15, 16]. Obwohl die mpMRT in nationalen und internationalen Leitlinien als fester Bestandteil der Primärdiagnose des Prostatakarzinoms empfohlen wird und Überdiagnostik sowie Übertherapie von klinisch nicht-signifikanten Prostatakarzinomen nachweislich reduziert werden können, wird sie in Deutschland von vielen gesetzlichen Krankenkassen nicht erstattet, und die Patienten müssen die Kosten häufig selbst tragen.
| Tumorstadium | Ausdehnung |
| T1 | Klinisch nicht erkennbarer Tumor: weder tast- noch sichtbar
|
| T2 | Auf die Prostata beschränkt, Prostatakapsel intakt
|
| T3 | Extraprostatisches Tumorwachstum, Tumor durchbricht die Prostatakapsel
|
| T4 | Infiltration von Nachbarorganen (über Samenblase hinaus): Harnblase, Rektum, Schließmuskel oder Beckenwand |
| Tabelle 1: Tumorstadium des Prostatakarzinoms [17] | |
Risikogruppen
Die EAU teilt das lokal begrenzte und lokal fortgeschrittene Prostatakarzinom abhängig vom 5-Jahres-Risiko eines biochemischen Rezidivs in drei verschiedene Risikogruppen ein. Hier werden der PSA-Wert, der Gleason-Score des Biopsiepräparates und das klinische Tumorstadium beachtet [4].
Der Gleason-Score bewertet die Aggressivität des Prostatakarzinoms anhand von Gewebsstruktur und Zellmuster. Dabei stellt sich der Gleason-Score aus zwei Gleason-Mustern zusammen. Die erste Zahl gibt das häufigste und die zweite Zahl das zweithäufigste Muster an. Ein höherer Gleason-Score zeigt eine stärkere Entdifferenzierung und somit höhere Aggressivität der Karzinomzellen an. Weiterhin wird der Gleason-Score gemäß der Internationalen Gesellschaft für Urologische Pathologie (ISUP) fünf Gruppen zugeordnet. Dabei stellt der Gleason-Score 6 die ISUP-Gruppe 1, Gleason-Score 7a (3+4) die ISUP-Gruppe 2, Gleason-Score 7b (4+3) die ISUP-Gruppe 3, Gleason-Score 8 die ISUP-Gruppe 4 und Gleason-Score 9 oder 10 die ISUP-Gruppe 5 dar.
Das Tumorstadium gibt die Ausdehnung an und unterscheidet zwischen klinischem (cT) und pathologischem (pT) Tumorstadium, wobei das primäre klinische Tumorstadium durch den DRU-Befund bestimmt wird. Ergebnisse bildgebender Verfahren wie mpMRT werden berücksichtigt, sofern sie den aktuellen Qualitätsrichtlinien entsprechen [5].
Risikogruppe | Kriterien | |
Niedriges Risiko | PSA 10 ng/ml und Gleason-Score ≤ 6 und cT1c, cT2a | lokal begrenztes Prostatakarzinom |
Intermediäres Risiko | PSA 10–20 ng/ml oder Gleason-Score 7 oder cT2b | |
Hohes Risiko | PSA > 20 ng/ml oder Gleason-Score > 7 oder cT2c | |
cT3–4 oder cN+, jeder PSA-Wert, jeder Gleason-Score | lokal fortgeschrittenes Prostatakarzinom | |
Abkürzungen: EAU = European Association of Urology, PSA = prostata-spezifisches Anitgen, cT = klinisches Tumorstadium | ||
Tabelle 2: EAU-Risikogruppen abhängig vom biochemischen Rezidivrisiko nach fünf Jahren für lokal begrenzte bzw. lokal fortgeschrittene Prostatakarzinome [4] | ||
Staging
Das konventionelle Staging beim Prostatakarzinom umfasst eine Computertomographie (CT) oder MRT der Beckenorgane sowie eine Skelettszintigraphie. Aufgrund des sehr niedrigen Risikos für Metastasen bei einem Niedrigrisiko-Prostatakarzinom empfiehlt die deutsche S3-Leitlinie Prostatakarzinom hier kein Staging [5]. Die CT- oder MRT-Untersuchung der Beckenorgane und eine Skelettszintigraphie werden bei einem Gleason-Score ≥ 8 oder einem Tumorstadium cT3/cT4 empfohlen. Zusätzlich wird die Skelettszintigraphie bereits bei einem PSA-Wert > 10ng/ml empfohlen. Dennoch ist ein Rezidiv nach kurativer Therapie bei Patienten mit hohem Risiko nicht selten, was teilweise auf die begrenzte Sensitivität und Spezifität des konventionellen Stagings zurückgeführt wird. Die PSMA-PET/CT weist im Vergleich zu CT/MRT und Skelettszintigraphie eine höhere Genauigkeit bei der Detektion von Prostatakarzinommetastasen auf [18]. Somit empfiehlt die deutsche S3-Leitlinie Prostatakarzinom die PSMA-PET/CT für Hochrisiko-Prostatakarzinome. Jedoch wird die PSMA-PET/CT trotz ihrer nachweislichen Vorteile im primären Staging der Hochrisiko-Patienten nur in sehr wenigen Ausnahmefällen von den gesetzlichen Krankenkassen erstattet und die Patienten tragen die Kosten selbst.
Therapie
Nachfolgend werden die Therapieoptionen des lokal begrenzten und lokal fortgeschrittenen Prostatakarzinoms laut deutscher S3-Leitlinie Prostatakarzinom erläutert [5].
- Aktive Überwachung Die aktive Überwachung hat sich als bedeutende Managementoption für Patienten mit einem lokal begrenzten Prostatakarzinom etabliert. Ziel ist hier, die aktive Behandlung und damit verbundene Nebenwirkungen einer aktiven Therapie wie Operation oder Bestrahlung bei Patienten mit einer Lebenserwartung von zehn Jahren oder mehr zu verzögern oder ganz zu vermeiden, ohne dabei das Gesamt- und prostata-spezifische Überleben zu beeinträchtigen. Zunächst war die aktive Überwachung vor allem Patienten mit einem Niedrigrisiko-Prostatakarzinom vorbehalten. Mit der Aktualisierung der europäischen Leitlinien im April 2024 und der deutschen S3-Leitlinie Prostatakarzinom im Mai 2024 wurde die Indikation der aktiven Überwachung nun erweitert. Nach den aktuellen Leitlinien sollte die aktive Überwachung allen Patienten mit einem Niedrigrisiko-Prostatakarzinom, mit Ausnahme von Patienten mit biologisch aggressiven Tumoranteilen (duktalen und/oder cribriformen Histologie), empfohlen werden. Neu ist auch, dass Patienten mit einem intermediären Risiko aktiv überwacht werden können. Laut der deutschen S3-Leitlinie sollten jedoch folgende Kriterien eines günstigen Risikoprofils erfüllt sein: ISUP Gruppe 2 mit einem Gleason-Muster 4 Anteil < 10 %, PSA-Wert < 15 ng/ml und kein Nachweis eines duktalen und/oder cribriformen Wachstumsmuster. Wichtig ist hier zu erwähnen, dass es keine einheitliche Definition für „das günstige“ Risikoprofil bei den Patienten mit einem intermediären Risiko gibt. Die EAU-Leitlinie gibt beispielsweise einen PSA < 10 ng/ml und ein Tumorstadium ≤ cT2a vor und hält an Kriterien wie „Anzahl der befallenen Stanzzylinder“ (≤ 3 positive Stanzzylinder mit einem Gleason 3+4) und „Karzinomanteil in den einzelnen Stanzzylindern“ (≤ 50 % Karzinomanteil pro Stanzzylinder) fest. Diese Kriterien werden in der deutschen S3-Leitlinie nicht mehr berücksichtigt, da durch die steigende Nutzung der mpMRT-Zielbiopsie ein ungenaues Bild erzeugt werden kann und es keine klaren Richtwerte zur Beurteilung des Tumorausmaßes gibt. Weiterhin ist die Wahrscheinlichkeit zur Identifizierung von kleinen Arealen des Gleason-4-Musters bei der mpMRT-Zielbiopsie höher als bei der systematischen Biopsie. Daher empfiehlt die deutsche S3-Leitlinie eher die Berücksichtigung der Ausdehnungs-/Volumetriekriterien der mpMRT Untersuchung. Grundsätzlich folgt die aktive Überwachung einem strukturierten Schema mit regelmäßigen PSA-Wert Kontrollen, mpMRT-Untersuchungen und Prostatabiopsien. Erst bei re-bioptisch gesicherter Krankheitsprogression wird eine aktive Therapie eingeleitet. Die aktive Überwachung erfordert eine ausführliche ärztliche Beratung, eine transparente Kommunikation zwischen Patienten und medizinischem Personal zur partizipativen Entscheidungsfindung sowie die Bereitschaft der Patienten, sich regelmäßigen mpMRT-Untersuchungen und vor allem Prostatabiopsien zu unterziehen.
- Radikale Prostatektomie Die radikale Prostatektomie stellt das primäre chirurgische Verfahren für die Behandlung des lokalisierten und lokal fortgeschrittenen Prostatakarzinoms dar. Dabei erfolgt die Entfernung der Prostata einschließlich Kapsel, Samenblasen, prostatanaher Samenleiteranteile und, abhängig vom Prostatakarzinomstadium, der regionalen Lymphknoten. Bei niedrigem Risiko kann auf eine Lymphadenektomie verzichtet werden. Verschiedene OP-Techniken, darunter offene, laparoskopische und roboterassistierte Verfahren, werden unterschieden. Das Hauptziel der radikalen Prostatektomie ist die effektive Kontrolle des Prostatakarzinoms durch komplette Entfernung der Prostata mit tumorfreien Resektionsrändern. Bei lokal fortgeschrittenem Karzinom und hohem Risiko für positive Resektionsränder sollten Patienten über mögliche weitere Maßnahmen im Rahmen eines multimodalen Therapiekonzepts (Bestrahlung, hormonablative Therapie) aufgeklärt werden. Durch die Auswirkung auf die gesundheitsbezogene Lebensqualität, sind die funktionellen Endpunkte, wie die Harninkontinenz und die Potenz, neben den onkologischen Ergebnissen von großer Bedeutung [19-22]. OP-Techniken, die auf der Erhaltung des neurovaskulären Bündels (NeuroSAFE – neurovascular structure-adjacent frozen-section examination) basieren, wurden entwickelt [23]. Diese intraoperative Schnellschnittanalyse ermöglicht die Identifikation von positiven Resektionsrändern, wodurch erst eine sekundäre Resektion der neurovaskulären Bündel der betroffenen Stelle erfolgt. Bei negativer Schnellschnittrandanalyse können die neurovaskulären Bündel erhalten bleiben. Eine weitere Technik zur Verbesserung der Kontinenz ist die FFLU-Technik (full functional-length urethra preservation), die auf der Identifikation und sorgfältigen Trennung der quergestreiften und glatten Muskulaturkomponenten des Harnröhrensphinkters basiert und somit zu besseren Kontinenzraten führt [24]. Somit können durch ein verbessertes anatomisches Wissen der Prostata mit Entwicklung neuer OP-Techniken die postoperativen Kontinenz- und Potenzraten verbessert werden [25-27]. Zusätzlich wurde festgestellt, dass Patienten, die in einem Prostatakarzinomzentrum mit hohem Fallvolumen operiert wurden, geringere Komplikationen und Nebenwirkungen sowie verbesserte onkologische Ergebnisse aufweisen [28-30].
- Perkutane Strahlentherapie Die perkutane Strahlentherapie zählt zu den primären Therapieoptionen beim lokal begrenzten und lokal fortgeschrittenen Prostatakarzinom. Die Standardfraktionierung erstreckt sich über mehrere Wochen mit täglichen oder wöchentlichen Bestrahlungen, wobei eine Dosis von mindestens 74 Gy bis etwa 80 Gy üblich ist. Dies ermöglicht es, die Strahlendosis zu erhöhen, während das umgebende Gewebe geschont wird. Gegenstand der aktuellen Forschung ist die hypofraktionierte perkutane Strahlentherapie, welche mit höheren Einzeldosen, geringerer Gesamtdosis und erheblich verkürzter Behandlungsdauer assoziiert ist [31, 32]. Durch fehlende Langzeitergebnisse hat diese jedoch noch keinen Einzug in die deutsche S3-Leitlinie Prostatakarzinom gefunden. Weiterhin wird zur Toxizitätsreduktion die intensitätsmodulierte Strahlentherapie (IMRT) empfohlen ebenso wie die bildgeführte Strahlentherapie (IGRT), bei der die Position der Prostata während der Bestrahlung mittels CT oder MRT überwacht werden kann. Für das lokal fortgeschrittene Prostatakarzinom wird die primäre perkutane Strahlentherapie in Kombination mit einer langfristigen hormonablativen Therapie empfohlen.
- Brachytherapie Im Gegensatz zur perkutanen Strahlentherapie handelt es sich bei der Brachytherapie um eine interne Strahlentherapie, bei der radioaktive Seeds direkt in die Prostata implantiert werden. Es gibt zwei Formen der Brachytherapie: die Low-Dose-Rate-Brachytherapie (LDR-Brachytherapie) für Prostatakarzinome mit niedrigem Risiko und die High-Dose-Rate-Brachytherapie (HDR-Brachytherapie) in Kombination mit perkutaner Strahlentherapie für Patienten mit mittlerem bis hohem Risiko. Die Indikation zur HDR-Brachytherapie besteht jedoch nicht bei Prostatakarzinomen im Tumorstadium cT4.
- Fokale Therapie Zusätzlich zu den Standardtherapien besteht für das lokal begrenzte Prostatakarzinom die Möglichkeit der fokalen Therapie. Dabei wird der selektiv vom Tumor befallene Teil der Prostata bzw. der Indextumor behandelt. Das Ziel ist ein kurativer Ansatz mit der vollständigen Eliminierung aller signifikanten Tumoranteile. Gemäß der aktuellen deutschen S3-Leitlinie Prostatakarzinom wird die fokale Therapie nur für Patienten mit unilateralem, lokal begrenztem Prostatakarzinom und niedrigem Risiko empfohlen, die eine Standardtherapie oder die aktive Überwachung ablehnen. Weitere Voraussetzungen sind ein Gleason Score von 6, ein PSA-Wert < 10 ng/ml, ein unauffälliger Tastbefund in der DRU, maximal 50 % positive Stanzen nur auf einer Seite in der systematischen Biopsie und die Diagnosesicherung durch eine mpMRT Zielbiopsie und eine systematische Biopsie. Weiterhin muss der Patient darüber informiert werden, dass zum aktuellen Zeitpunkt kein wissenschaftlicher Gleichwertigkeitsnachweis der fokalen Therapie zu den Standardtherapien vorliegt. Nach der fokalen Therapie sollten, angelehnt an das Protokoll der aktiven Überwachung, alle sechs bis zwölf Monate mpMRT Zielbiopsien und systematische Biopsien durchgeführt werden. Beispiele für fokale Therapieansätze sind die gezielte photodynamische Therapie (VTP), die hochintensive fokussierte Ultraschallablation (HIFU) und die irreversible Elektroporation (IRE).
- Watchful Waiting Beim sog. Watchful Waiting (beobachtendes Abwarten) handelt sich es sich, anders als bei den oben genannten Therapien, um kein kuratives, sondern um ein palliatives Vorgehen. Im Fokus steht hier die sekundäre symptomorientierte Therapie. Das Watchful Waiting folgt hier keinem festgelegten Überwachungsprotokoll und wird in der Regel für Patienten mit einer Lebenserwartung von weniger als zehn Jahren empfohlen. Das Ziel ist, therapiebedingte unerwünschte Nebenwirkungen und Toxizität zu vermeiden. Dabei können auch Patienten, die sich in der aktiven Überwachung befinden und deren Lebenserwartung im Verlauf auf unter zehn Jahre sinkt, in das Watchful Waiting übergehen.
- Primär hormonablative Therapie Die primäre hormonablative Therapie ist ebenfalls eine palliative Therapieoptionen für Patienten, die eine kurative Therapie, aber auch ein Watchful Waiting ablehnen. Hier ist vor allem die Aufklärung der unerwünschten Nebenwirkungen wichtig. Häufige Nebenwirkungen sind Hitzewallungen, Schweißausbrüche, Gewichtszunahme, reduzierte Knochendichte, Muskelschwäche, verminderte Energie/Antrieb, Müdigkeit, Stimmungsschwankungen und depressive Verstimmungen.
Rehabilitation
Die Rehabilitation nach lokaler Prostatakarzinomtherapie spielt eine zentrale Rolle, indem sie nicht nur die gesellschaftliche Teilhabe fördert, sondern auch postoperative und postradiogene Funktionsstörungen anspricht. Neue OP-Techniken wie NeuroSAFE und FFLU konnten die Harninkontinenzraten reduzieren[24, 25, 27]. Dennoch kann die Harninkontinenz weiterhin eine unerwünschte Nebenwirkung sein, welche mit einer verminderten Lebensqualität und erhöhtem seelischem Stress nach lokaler Prostatakarzinomtherapie einhergeht [22]. Eine postoperative Harninkontinenz muss jedoch nicht persistieren. Ein professionelles Kontinenztraining, insbesondere physiotherapeutisch angeleitetes Beckenbodentraining, ist von großer Bedeutung und kann die Harnkontinenz verbessern [33]. Aktuelle Daten deuten darauf hin, dass ein präoperatives Kontinenztraining bei Patienten, die eine radikale Prostataektomie durchführen lassen, ebenfalls die Harnkontinenz verbessern kann [34, 35].
Die erektile Dysfunktion stellt eine weitere relevante postoperative Funktionsstörung dar. Obwohl sich die Raten der erektilen Dysfunktion nach radikaler Prostatektomie mit neurovaskulärem Bündelerhalt verbessert haben, bleibt die erektile Dysfunktion mit einer schlechteren Lebensqualität assoziiert [36]. Die Therapie der postoperativen erektilen Dysfunktion erfolgt nach einem Stufenschema, beginnend mit Phosphodiesterase-5-Inhibitoren (PDE-5-Hemmer) und kann bei Bedarf mit intrakavernösen Injektionen, intraurethralen Prostaglandinen oder Vakuumerektionshilfen, kombiniert mit physiotherapeutischem Training eskaliert werden. Dabei hängt die Therapiewahl von Patientenpräferenzen und weiteren, meist kardiovaskulären Begleiterkrankungen ab. Studien belegen, dass Verbesserungen in der Kontinenz und der erektilen Funktion auch nach einem Zeitraum von zwölf Monaten weiterhin möglich sind, was eine ermutigende Perspektive für Patienten darstellen sollte [37, 38].
Zusätzlich sollten Prostatakarzinompatienten über psychoonkologische Beratungsmöglichkeiten informiert werden. Dies kann sowohl im Rahmen einer Anschlussheilbehandlung, jedoch auch ambulant stattfinden. Weiterhin müssen von der Deutschen Krebsgesellschaft (DKG) zertifizierte Prostatakarzinomzentren eine ambulante psychoonkologische Beratung anbieten.
Nachsorge
Nach erfolgter kurativ intendierter Therapie sollte eine sogenannte PSA-gesteuerte Nachsorge erfolgen. In den ersten zwei Jahren sollte diese alle drei Monate stattfinden. Anschließend sollte der Zeitraum im dritten und vierten Jahr auf alle sechs Monate verlängert werden. Ab dem fünften Jahr erfolgt die PSA-Bestimmung jährlich. Die erste PSA-Wert-Bestimmung nach kurativ intendierter Therapie sollte innerhalb von sechs bis zwölf Wochen erfolgen, um einen adäquaten PSA-Abfall zu beobachten. Nach einer radikalen Prostatektomie sollte der PSA-Wert unter die Nachweisgrenze fallen. Bei der perkutanen Strahlentherapie gilt der PSA-Nadir als Referenzwert. Hierbei gibt der PSA-Nadir den tiefsten erreichten PSA-Wert an.
Fazit
Das Prostatakarzinom zählt zu den häufigsten Krebserkrankungen bei Männern in Deutschland und gewinnt angesichts des demografischen Wandels sowie der steigenden Lebenserwartung noch mehr an Bedeutung. Eine kurative Behandlung ist im nicht-metastasierten Stadium möglich. Neben der DRU, die Teil der gesetzlichen Früherkennung ab 45 Jahren ist, spielt der patientenorientierte risikoadaptierte Einsatz des PSA-Wertes eine entscheidende Rolle bei der Früherkennung. Die Integration neuer diagnostischer Methoden wie der mpMRT in der Primärdiagnostik und der PSMA-PET/CT im Staging verbessert die Identifizierung von klinisch-signifikanten Prostatakarzinomen und von Metastasen bei Hochrisiko-Patienten. Diese Verfahren werden jedoch von den gesetzlichen Krankenkassen meist nicht bezahlt und die Patienten müssen selbst für die Kosten aufkommen. Für die Therapie des organbegrenzten Prostatakarzinoms ist die individuelle krebsspezifische Risikokategorie zu berücksichtigen. Weiterhin müssen sorgfältig das individuelle Patientenalter, die Lebenserwartung, die Komorbiditäten sowie Patientenpräferenzen in der Therapieentscheidung beachtet werden. Neben den kurativen Therapiestrategien wie aktive Überwachung, radikale Prostatektomie und Strahlentherapie können bei einer Lebenserwartung von weniger als zehn Jahren palliative Konzepte wie das Watchful Waiting und die hormonablative Therapie eingesetzt werden. Eine professionelle Rehabilitation nach der Behandlung ermöglicht, Funktionsstörungen wie eine Harninkontinenz oder eine erektile Dysfunktion zu verbessern. Die PSA-gesteuerte Nachsorge spielt eine wichtige Rolle zur Überwachung der Therapieeffektivität und frühzeitigen Erkennung von Rezidiven oder Progression.
Das nicht-metastasierte Prostatakarzinom erfordert somit eine individualisierte Herangehensweise für optimale Ergebnisse und zur Erhaltung der Lebensqualität der Patienten.
Dr. med. Cristina Cano Garcia, Dr. med. Clara Humke, Dr. med. Benedikt Höh, Dr. med. Mike Wenzel, Prof. Dr. med. Philipp Mandel, Prof. Dr. med. Felix K. H. Chun, Goethe-Universität Frankfurt, Universitätsklinikum, Klinik für Urologie, Korrespondenz per E-Mail: cristina.cano.garcia.ukf@gmail.com
Die Literaturangaben finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Lokal begrenztes und lokal fortgeschrittenes Prostatakarzinom“ von Dr. med. Cristina Cano Garcia, Dr. med. Clara Humke, Dr. med. Benedikt Höh, Dr. med. Mike Wenzel,Prof. Dr. med. Philipp Mandel und Prof. Dr. med. Felix K. H. Chun finden Sie im Portal sowie in der PDF-Version dieses Artikels. Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Portal vom 25.09.2024 bis 24.03.2025 möglich. Die Fortbildung ist mit drei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen.
Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte. (red)