Einleitung
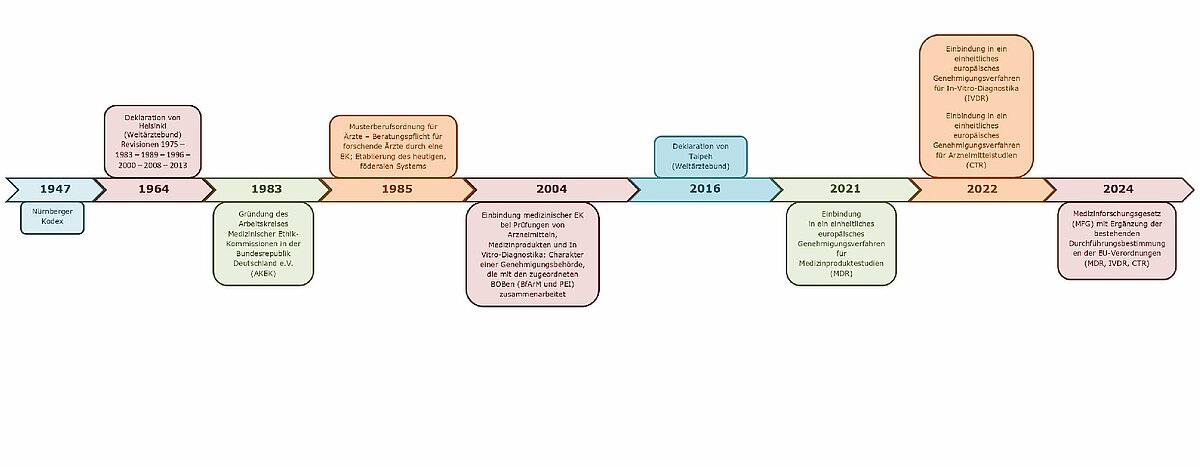
Weltweit gilt, dass ein Forschungsvorhaben am Menschen vor Studienbeginn zur Erwägung, Stellungnahme, Beratung und Zustimmung einer zuständigen Forschungs-Ethikkommission vorzulegen ist. Für die etwa 10.000 solcher Vorhaben, die in Deutschland jährlich initiiert werden, gibt es mehr als 50 nach Landesrecht gebildete Ethikkommissionen (EK) an Medizinischen Fakultäten bzw. Universitäten, Landesärztekammern und als Einrichtungen der Bundesländer. Seit ihrer Einführung in den 1980er-Jahren (s. Abb.) ist es ihre Aufgabe, Forschungsprojekte der epidemiologischen, klinischen und Versorgungsforschung an und mit Menschen berufsethisch wie berufsrechtlich zu beraten und zu beurteilen. Grundlage ist hier zunächst die Deklaration von Helsinki (DoH) und § 15 der Berufsordnung für die in Deutschland tätigen Ärztinnen und Ärzte. Insbesondere hat aber die seit 2004 bestehende Einbindung medizinischer EK in den inzwischen europäisch geregelten Gesetzesrahmen bei Prüfungen von Arzneimitteln, Medizinprodukten und In Vitro-Diagnostika ihre Aufgaben erweitert; sie haben in diesen Feldern den Charakter einer Genehmigungsbehörde bekommen, die mit den zugeordneten Bundesoberbehörden (BOB/BfArM und PEI) zusammenarbeitet. Durch ihre nunmehr fast 20-jährige Tätigkeit bei der Bewertung von Arzneimittelprüfungen haben die Ethikkommissionen eine sehr große Expertise sammeln können, so auch bei komplexen Studienvorhaben.
Die Ethikkommission der LÄKH umfasst medizinische Expertinnen und Experten aus allen großen Fachdisziplinen, Personen mit Erfahrung in medizinischer Ethik, Juristen, Pharmakologen sowie medizinische Laien. Alle EK sind im Arbeitskreis Medizinischer Ethik-Kommissionen (AKEK) zusammengefasst, der regelmäßig Fortbildungen für Mitglieder anbietet. Ferner sind die den Ärztekammern angegliederten EK durch die Ständige Konferenz der Geschäftsführungen und der Vorsitzenden der Ethik-Kommissionen der Landesärztekammern (SKO EK LÄK) organisiert.
Bewertung eines Forschungs- vorhabens durch eine EK
Die fundamentale ethische Herausforderung bei medizinischer Forschung mit Menschen besteht darin, eine Ausnutzung bzw. Instrumentalisierung der betroffenen Personen (Patienten oder Probanden) zu verhindern.1 Dimensionen, die bei der Bewertung von Forschungsvorhaben durch eine EK kritisch geprüft werden, betreffen u. a. den Nutzen des Vorhabens für die Gesellschaft (social value), die wissenschaftliche Validität (scientific validity), die Auswahlkriterien der Studienteilnehmer (fair participant selection), das Risiko-Nutzen-Verhältnis (favorable risk-benefit ratio), sowie die Informierte Einwilligung (informed consent). Bei der ethischen Bewertung einer Studie stehen das Nil Nocere Prinzip (keinem Patienten einen studienbedingten Schaden zumuten) und Prinzip der Gruppennützigkeit (Zumutbarkeit eines individuellen Schadens für den Preis einer validen Erkenntnis von Wirksamkeit und Risiken des neuen Arzneimittels für eine Patientengruppe) in einem konkurrierenden Verhältnis. Sie können nur durch die Berücksichtigung der o. g. Prinzipien in Übereinstimmung gebracht werden.
Allen Prinzipien kommt derselbe Stellenwert zu, aber insbesondere die unabhängige Begutachtung als solche sichert das Vertrauen der Studienteilnehmer, nicht als bloßes Objekt einer wissenschaftlichen Fragestellung instrumentalisiert zu werden.
Das aktuelle Verfahren bei klinischen Arzneimittelprüfungen
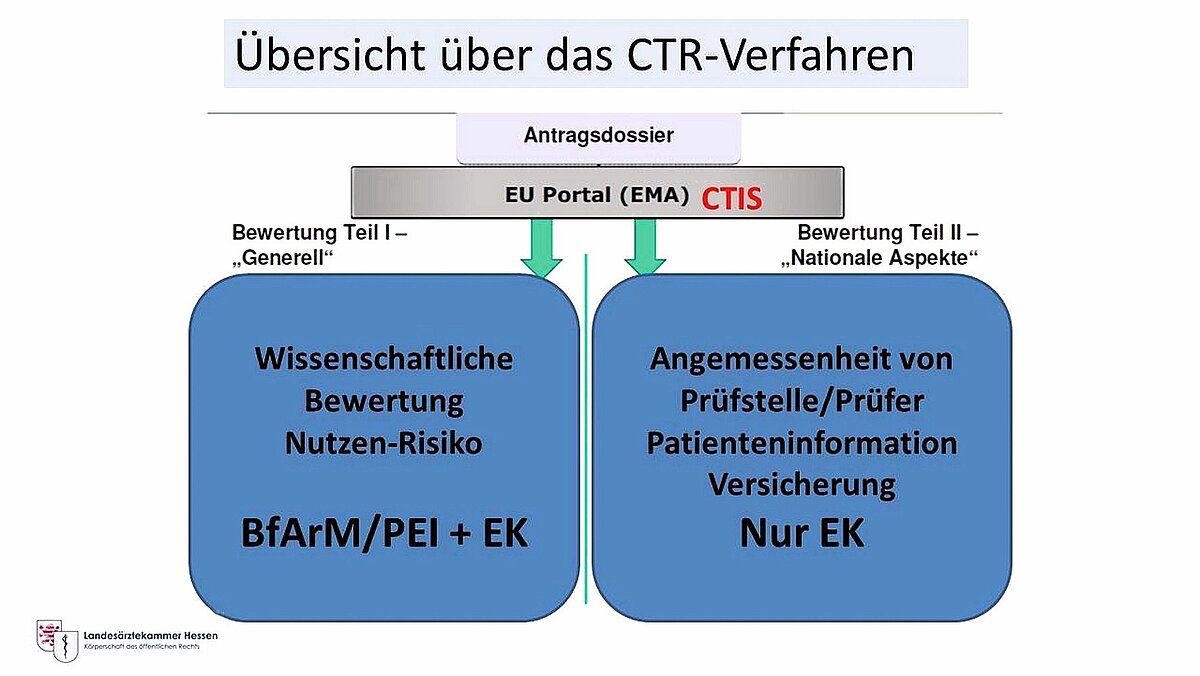
Die Clinical Trials Regulation (CTR) ist die EU-weite Verordnung zum Genehmigungsverfahren sogenannter Klinischer Arzneimittelprüfungen und kommt nach der sich über mehrere Jahre hinstreckenden Einrichtung der benötigten Arbeitsplattform – Clinical Trial Information System (CTIS) – seit dem 01.02.22 zur Anwendung. Über CTIS (siehe Abb. 1) werden die Anträge gestellt und durch die Mitgliedsstaaten (MS) bearbeitet.
Das Verfahren soll für Antragsteller einen beschleunigten Beginn multinationaler Arzneimittelstudien ermöglichen. Es sieht für alle klinischen Prüfungen in der EU eine zentrale Einreichung des Genehmigungsantrages vor, die für alle Länder gleichzeitig erfolgen kann. Die grundsätzlichen Regeln der Bewertung und Genehmigung solcher Studien sind in jedem MS gleich. In Deutschland wird die Zusammenarbeit von Ethikkommissionen und Bundesoberbehörden durch die Klinische Prüfung-Bewertungsverfahren-Verordnung (KPBV) geregelt.
Der Antragsteller hat keine Möglichkeit, sich eine bestimmte EK auszusuchen – wie das zuvor der Fall war. Es muss eine Benehmensfindung (Konsolidierung) abgeschlossen werden, bevor die BOB die Entscheidung für den MS Deutschland trifft und an den Sponsor übermittelt. Seit 2022 arbeiten so EK und BOB eng zusammen, Hinweise auf relevante Verfahrensmängel bei der Zusammenarbeit wurden nicht bekannt.
Das Medizinforschungsgesetz (MFG)
Seit dem 27.03.2024 liegt der Kabinettsentwurf für ein neues MFG vor, das die Rahmenbedingungen für die Entwicklung, Zulassung und Herstellung von Arzneimitteln und Medizinprodukten verbessern soll, um die Attraktivität des Standorts Deutschland im Bereich der medizinischen Forschung zu stärken und in Folge Wachstum und Beschäftigung zu fördern, so der Text der Gesetzesbegründung. Neben anderen, durchaus positiv zu bewertenden Bestandteilen dieses Gesetzes (z. B. Änderung des Strahlenschutzgesetzes und des Medizinprodukterecht-Durchführungsgesetzes zur Verfahrensharmonisierung) ist der zentrale Punkt im Rahmen der Änderung des AMG – die Einführung einer außerhalb des Geschäftsverteilungsplan (GVP) agierenden sog. Spezialisierten Ethikkommission für besondere Verfahren, welche einen nicht unerheblichen Teil der bisherigen Aufgaben der EK im Rahmen der Genehmigungsverfahren übernehmen soll.
Seit Bekanntmachung eines ersten Referentenentwurfes für das MFG wurden bereits ausführliche Stellungnahmen des AKEK, der Bundesärztekammer sowie der „Initiative Studienstandort Deutschland“ , der u. a. der MFT, die AWMF sowie maßgebliche Verbände der deutschen Pharmaindustrie – VFA, BPI, u. a. m. – angehören, veröffentlicht: Sie alle lehnten die Einrichtung einer unter Bundesaufsicht stehenden EK einhellig ab. Der nun vorliegende Kabinettsentwurf wurde trotzdem zur Vorfassung lediglich marginal abgeändert.
Der Kabinettsentwurf führt aus: „Bei dem Bundesinstitut für Arzneimittel und Medizinprodukte wird die Spezialisierte Ethik-Kommission für besondere Verfahren eingerichtet. Das Bundesministerium beruft im Benehmen mit dem Bundesministerium für Bildung und Forschung die Mitglieder [...]. Die Geschäftsordnung bedarf der Zustimmung des Bundesministeriums im Benehmen mit dem Bundesministerium für Bildung und Forschung.“ Dem Ansinnen der Einführung einer solchen EK muss entgegengehalten werden, dass an die Regierung angeblich herangetragene Klagen seitens der Sponsoren hinsichtlich Zeitverzögerungen durch unprofessionelles Handeln von EK primär vordergründig deren eigenem Interesse einer reibungsfreien Genehmigung dienen, die aber im Einzelfall nicht zu substantiieren sind.
Das Gesetz eröffnet nun einen privilegierten Zugang zu einem – so in der Gesetzesbegründung – vereinfachten und beschleunigten Genehmigungsverfahren bei dieser spezialisierten EK bei vier Studientypen. Die Kategorie 1 („EMA-Task-Force-Studien“) und 4 („ATMP-Studien“) beruht auf klar formulierten Kriterien. Der jährliche Umfang von Anträgen in diesen Kategorien ist gering und dürfte eher im einstelligen Bereich liegen. Die Kategorien 2 (Studien zur Erstanwendung am Menschen, FIH) und 3 (sog. komplexe Studien auf der Basis sog. Masterprotokolle) sind dagegen überhaupt nicht trennscharf formuliert und finden sich so auch nicht in der von CTIS vorgegebenen Einordung der „Trial Category“ wieder.
Entgegen der weitverbreiteten Annahme, FIH würden nur bei gesunden Probanden durchgeführt, beziehen diese Studien je nach Wirkstoffklasse auch schwerkranke Patienten mit ein. Bei der Bewertung der Risiken und des Nutzens solcher an Patienten durchgeführten Studien ist die klinische Situation des Patienten sowie auch seine psychologische Disposition hinsichtlich der Einschätzung seiner Vulnerabilität eine entscheidende ethische Dimension und kaum zu vereinfachen und zu beschleunigen. Gerade hier müssen auch die Patienteninformationen kritisch geprüft sein.
Diese Studien betreffen fast alle medizinischen Indikationsbereiche und damit die gesamte Bandbreite klinischer Arzneimittelstudien. Da komplexe Studientypen auch hinsichtlich der Zulassungsbehörden international propagiert werden2, ist damit zu rechnen, dass mittelfristig pro Jahr ca. 1/5 aller klinischen Prüfungen – in D wären das dann etwa 200 – unter dieser Flagge segeln können. Dieses entspricht dem jährlichen Antragsvolumen von 4–5 EK. Es stellt sich auch die Frage, ob ein Antragsteller mit der Selbsteinstufung „Komplexe Studie“ einen Antrag in seinem Sinne (vereinfacht und beschleunigt) günstig platzieren kann, ohne dass dieser Anspruch im Einzelfall durch eine zeitintensive vorgeschaltete Prüfung auf den Anspruch validiert ist.
Es muss klar sein, dass bei der Bewertung solcher FIH und/oder komplexer Studien eine kritische Sicht durch klinische Experten der jeweiligen Fachrichtungen unabdingbar ist. Auch darf – primär aus ökonomischen Erwägungen heraus geforderte – Eile hier nicht die Tiefe des Bewertungsprozesses korrumpieren. Eine einzelne spezialisierte EK, die zeitgerecht und unter Berücksichtigung einer Verkürzung des Zeitrahmens für die Vielfalt und Menge dieser Studien trotzdem mit gebotener Sorgfalt arbeitet, kann nach Ansicht der Autoren nur hauptamtliche Mitglieder rekrutieren, auch wenn das im gegenwärtigen Gesetzesentwurf nicht vorgesehen ist. Eine Hauptamtlichkeit mit Anstellung an einer Bundesbehörde muss jedoch als klarer Verstoß gegen die DoH – zumindest im Hinblick auf die Unabhängigkeit – angesehen werden.
Neben der eigentlichen, unter behördlicher Kuratel stehenden Spezial-EK sieht der Gesetzesentwurf ferner eine an bestimmte Merkmale gebundene Zuweisung von Studien außerhalb der o. g. 4 Kategorien an hierauf spezialisierte EK innerhalb des AKEK vor. In Betracht kommt gemäß der Gesetzesbegründung z. B. eine Spezialisierung auf bestimmte medizinische Indikationen, Bevölkerungsgruppen oder Studienphasen oder -typen. Bei der Erstellung des hierfür vorgesehen, besonderen GVP sollen die BOB angehört werden müssen. Dieses Ansinnen muss ebenfalls strikt abgelehnt werden. Keine EK der medizinischen Fakultäten oder der Kammern möchte einer inhaltlichen Monokultur unterworfen werden. Die ethische Bewertung einer Studie erfolgt grundsätzlich für jede Erkrankung nach denselben Prinzipien. Für die Notwendigkeit von derart spezialisierten EK hat der Gesetzgeber ebenfalls keine z. B. auf konkrete Defizite des bisherigen Verfahrens zielende Begründung außer der allgemeinen Forderung nach einem vereinfachten und beschleunigten Genehmigungsverfahren erbracht. Die Zuweisung von Studien an die zuständige EK nach Indikationen (z. B. Herzinsuffizienz oder Asthma) steht ferner dem Anspruch nach umfassender Expertise jeder einzelnen EK entgegen, wie sie im Übrigen für alle anderen berufsrechtlich zu beratenden Studien außerhalb der behördlichen Genehmigungsverfahren ohnehin unerlässlich ist. Die multidisziplinäre Zusammensetzung der bestehenden EK gewährleistet diese Expertise schon seit langem, und externe Experten konnten (§ 41 (2) AMG) schon immer zu Rate gezogen werden.
Fazit
EK haben weltweit primär die Aufgabe, den Schutz der Rechte, der Sicherheit und des Wohlergehens von Studienteilnehmern zu sichern. Sie in eine Behördenstruktur auf Bundesebene einzugliedern, setzt sie unmittelbar standortpolitischen Erwägungen aus. Gerade bei komplexen und damit inhärent auch riskanten Forschungsvorhaben soll jetzt eine EK, die im direkten Windschatten mit der genehmigenden Behörde arbeitet, tätig werden. Der Bund hat die seit Jahrzehnten in den Ländern bestehende Regelung, dass Mitglieder einer EK unabhängig, an Weisungen nicht gebunden und nur ihrem Gewissen verantwortlich sind, empfindlich herausgefordert. Die institutionelle Unabhängigkeit der EK ist ein zentrales Element für den Patientenschutz und die gesellschaftliche Akzeptanz der Forschung am Menschen. Eine neue EK, die jetzt antritt, um den Antragstellern weniger Probleme zu bereiten und „beschleunigt“ zu arbeiten, und bei einer Behörde oder einem Ministerium angesiedelt ist, kann aber kaum noch als unabhängig bezeichnet werden. Dieser Umstand dürfte auch wenig förderlich sein für die Bereitschaft, als betroffener Patient an einer Studie teilzunehmen.
Dr. Anja Schneider, Leiterin der Geschäftsstelle der Ethik-Kommission Landesärztekammer Hessen
Prof. Dr. med. Sebastian Harder, Vorsitzender der Ethikkommission Landesärztekammer Hessen
1 Ein Rahmen für diese Bewertungsperspektive wurde zuletzt von Ezekiel Emanuel et al. 2008 im Standardwerk der Forschungsethik, dem Oxford Textbook of Clinical Research Ethics publiziert.
2 EMA/298712/2022. Complex clinical trials – Questions and answers Version 2022-05-23