Dr. med. Lena Marie Seegers
Ein Abkürzungsverzeichnis finden Sie am Ende des Artikels.
Einleitung
Geschlechtsspezifische Unterschiede im Outcome und aktuelle Qualität der medizinischen Versorgung von Frauen
Sie dachte, sie sei vielleicht nur ängstlich. Aber es fühlte sich an, als wäre sie in einem Boxkampf ohne Handschuhe gewesen, mit Schmerzen in den Handgelenken und Ellenbogen, in der Brust und im Rücken. Sie saß fast eine Stunde im Bett, bevor sie ein Schmerzmittel nahm und wieder einschlief. Am Montag vereinbarte sie einen Arzttermin für Donnerstag. In der Zwischenzeit sagte sie sich, dass sie wohl nicht mehr in Form sei, und forderte sich heraus, täglich 5 km auf dem Laufband zu laufen. Bei ihrem Termin führte der Arzt ein EKG durch und sagte, sie müsse ins Krankenhaus. Dort sah ein weiteres EKG so besorgniserregend aus, dass der Kardiologe sagte, er wolle, dass sie einen Stresstest mache...
Die 45-jährige Amerikanerin Dina Pinelli, deren linke vordere Herzkranzarterie (LAD) vollständig verschlossen war, erhielt mit etlicher Verzögerung dann doch noch eine Koronarangiographie mit lebensrettender Revaskularisation [1] – Ein Einzelfall? Eher nicht. Studien zeigen, dass lebensrettende Maßnahmen beim Herzinfarkt bei Frauen im Durchschnitt später ergriffen werden als bei Männern [2]. Dabei betreffen kardiovaskuläre Erkrankungen ca. 275 Mio. Frauen weltweit und sind die häufigste Todesursache von Frauen, wie bei Männern auch. Sie sind damit für 35 % aller Todesfälle bei Frauen verantwortlich [3–4]. Studienumfragen zufolge ist dies allerdings nur 56 % aller Frauen bewusst [5]. Hingegen ist die Sorge vor Brustkrebs bei Frauen in jüngerer Zeit zunehmend ins Bewusstsein gerückt, nicht zuletzt durch Kampagnen für die Mammographie, die Frauen bewegen sollen, zur Brustkrebsvorsorge zu gehen. Tatsächlich sind Herzerkrankungen bei Frauen häufiger als alle Tumorarten zusammen [6].
Lange verkannt als „Männererkrankung“ galt vor allem der Myokardinfarkt bei Frauen für Jahrzehnte als unterdiagnostiziert. Galt? Bei weltweit verbessertem Outcome sterben speziell in Europa mehr Frauen an einem Herzinfarkt als Männer [7], aber auch in Deutschland versterben insbesondere beim ST-Hebungsinfarkt (STE-ACS) mehr Frauen als Männer, und sie erhalten weniger leitliniengerechte pharmakologische und invasive Therapien [8]. Dass es Unterschiede bei Frauenherzen gibt, ist seit mehreren Jahrzehnten bekannt.
| Tabelle 1: Versorgungsunterschiede bei Frauen |
| Späterer Arztkontakt: 80 Min. (bei Frauen) versus 75 Min. (bei Männern). |
| Erhalten seltener eine Herzdruck-Massage, 23 % Überlebensvorteil für Männer. |
| Präklinisch weniger Diagnostik und Therapie. |
| Spätere Vorstellung einer Patientin durch den Notarzt in der Notaufnahme, durchschnittlich 30 min später als männliche Patienten. |
Frauen erhalten seltener eine leitliniengerechte Therapie, insbesondere
|
| Die Mortalität im Krankenhaus ist bei Frauen höher. |
| Die Mortalität bei einem Herzinfarkt ist nach 30 Tagen und nach fünf Jahren bei Frauen höher als bei Männern. |
Die Ursachen für die geschlechtsspezifischen Unterschiede sind allerdings multifaktoriell und zum Teil unverstanden, da Frauen lange Zeit – und noch heute – in Studien unterrepräsentiert sind. Die unterschiedliche Versorgung ist bereits in der präklinischen Phase belegt, also bevor die Frau in die Notaufnahme kommt. So erhielten nach einer groß angelegten australischen Studie 2023 Frauen mit Brustschmerz vom Notarzt weniger Medikamente, hierbei auch weniger Analgetika, es wurden seltener EKGs geschrieben oder intravenöse Zugänge gelegt, und sie wurden seltener in ein Krankenhaus transportiert als Männer [9]. Was sich wie ein Relikt aus dem Mittelalter liest, ist Versorgungsalltag in der westlichen Welt, in Europa und auch in Deutschland [8]. Selbst eine Reanimation mit Herz-Druckmassage wird signifikant seltener durchgeführt mit einem Überlebensvorteil von 23 % für Männer [10]. Im Krankenhaus kommt es statistisch dann ebenfalls zu weniger Diagnostik und verspätetem Arztkontakt und schlussendlich wird seltener und später eine Koronarangiographie mit perkutaner koronarer Koronarintervention (PCI) durchgeführt und ein Intensivbett zur Verfügung gestellt. Revaskularisationszeiten waren hierbei in Studien bei Frauen mit ST-Hebungsinfarkt rund 30 min. verzögert als bei Männern [2, 9, 11] – eine zu große Zeitspanne, denn bei einem Herzinfarkt zählt jede Minute.
| Tabelle 2: Hauptsymptome beim weiblichen Myokardinfarkt |
| Brustschmerzen |
| Schulter-, Oberbauch-, Armschmerzen |
| Dyspnoe |
| Schwindel und Übelkeit, Erbrechen |
| Schwitzen |
| Angst |
| Ausgeprägte Müdigkeit/Erschöpfung |
Was sind die Gründe, dass es in der heutigen Zeit auch in der modernen westlichen Welt noch so gravierende Versorgungsdefizite für weibliche Patienten gibt, andererseits sich der Herzinfarkt bei Frauen wie bei Diane Pinelli offensichtlich schleichend schon Tage vorher anbahnt? Der Schlüssel liegt vermutlich in einem vielschichtigen Konstrukt, oder kurz gesagt, es handelt sich bei dem weiblichen Herzinfarkt um einen grundsätzlich anderen ischämischen Phänotyp als dem des Mannes, ein Ergebnis aus einer abweichenden Anatomie, biologischen Risikofaktoren, Pathophysiologie und der letztlich wenig untersuchten und verstandenen klinischen Präsentation. Das fehlende Bewusstsein und auch unzureichendes Wissen führen dann konsekutiv zu einer erhöhten Mortalitätsrate.
Die „Lancet women und cardiovascular disease“-Kommission, die erste internationale Kommission mit ausschließlich weiblichen Mitgliedern, hat sich daher zum Ziel gesetzt das globale Ausmaß an Herzerkrankungen bei Frauen bis 2030 zu reduzieren und das Outcome zu verbessern. Die Kommission fasst das Problem hierbei folgendermaßen zusammen: „Kardiovaskuläre Herzerkrankungen bei Frauen sind und bleiben zu wenig erforscht, zu wenig erkannt und beachtet, zu wenig diagnostiziert und untertherapiert, mit Frauen, die unterrepräsentiert in klinischen Studien sind“ [12].
Klinische Präsentation: „Atypical chest pain is out“
Ein entscheidender Schritt zur Verbesserung des Outcomes bei Herzinfarkt ist eine rasche Diagnosestellung. Hierbei zeigen sich bei Frauen sowohl Unterschiede auf Arzt- als auch auf Patientenebene, die bisher wenig berücksichtigt werden. Angina pectoris ist in den Lehrbüchern das Leitsymptom für den Herzinfarkt, wobei hierbei der Mann als Norm genommen wird. Wichtig ist, zunächst festzuhalten, dass Frauen sogar häufiger Brustschmerzen haben als Männer [13]. Diese müssen jedoch nicht unbedingt von der Patientin als belastungsabhängiges retrosternales Druckgefühl mit Ausstrahlung in den linken Arm beschrieben werden. Früher wurden Brustschmerzen daher bei Frauen oft als „atypische Angina pectoris“ bezeichnet. Studien haben gezeigt, dass es keinen Vorteil für Frauen gibt, den Brustschmerz, der nicht als die „klassische“ (nach dem Mann orientierte) Angina pectoris Symptomatik geschildert wird, zu verharmlosen, indem man mittels Beschreibungen eines „atemabhängigen“, „stechenden“, „auf Druck auslösbaren“ Schmerzes, der „unabhängig von Belastung“ sei, versucht, den Brustschmerz als atypisch zu bezeichnen. Dies führt zu einer Verzögerung und Bagatellisierung der Beschwerden, sodass bei der Frau wichtige Diagnostik (EKG, Bestimmung der Herzenzyme durch eine Blutentnahme, Durchführung einer Koronarangiographie) im schlimmsten Fall unterlassen wird, da man die Symptomatik fälschlicherweise als ungefährlich und somit als sehr unwahrscheinlich für einen Herzinfarkt falsch eingeordnet hat. In den neuen Brustschmerzleitlinien der American Heart Association (AHA) ist die Bezeichnung atypischer Brustschmerz daher nicht mehr empfohlen. Dies wurde endlich auch in den neuen Leitlinien der European Society of Cardiology (ESC) zum Chronischen Koronarsyndrom festgehalten. Erschwerend kommt hinzu, dass die Frau sich allerdings mit einer größeren Fülle an Begleitsymptomen präsentiert. Zum Beispiel treten bei Frauen häufiger Dyspnoe, Übelkeit, Erbrechen, Angstzustände, Unwohlsein, Rücken- oder Kieferschmerzen oder übermäßige Müdigkeit auf, teilweise auch ohne Schmerzen in der Brust. Dyspnoe ist mittlerweile laut der neuen Leitlinie in ihrer Gewichtung ein Angina pectoris Äquivalent [14, 15].
Nicht berücksichtigt werden die genderspezifischen Unterschiede hinsichtlich der Kommunikation von Symptomen. So muss die eher emotional geprägte Kommunikation von Frauen mit detaillierten Angaben zu Vorgeschichte und Aktivitäten, der Reihenfolge und der Fülle der Symptome als solchen in Relation gesetzt werden, um bei der Patientin eine akkurate Diagnose stellen zu können. Fehldiagnosen werden verstärkt durch die schlecht charakterisierte und unterdiagnostizierte koronare Mikrozirkulationsstörung, die bei Frauen häufiger auftritt. Die hohe Anzahl an diffusen Begleitsymptomen führt unter anderem dazu, dass Frauen später in die Notaufnahme kommen und auch die Diagnose bei Frauen durch den Arzt signifikant später gestellt wird [11]
Alter: Chronologisches versus biologisches Alter
Ein erheblicher Unterschied von Frauenherzen besteht in dem Auftreten von Atherosklerose hinsichtlich der Lebensspanne. Frauen entwickeln im Durchschnitt zehn Jahre später Atherosklerose mit 20 Jahre späterem Auftreten eines Erstereignisses, z. B. eines Myokardinfarktes. [16–17]. Dabei ist ein erheblicher Risikoanstieg hierfür nach der Menopause zu verzeichnen. Eine besonders wichtige Phase ist somit bereits die Perimenopause bei Frauen mittleren Alters (48–53 Jahren) [18]. Neben der Erfassung des chronologischen Alters ist eine frühzeitige Menopause (< 40 Jahren) wichtig zu anamnestizieren und aktiv zu erfragen. Die speziell-gynäkologische Anamnese ist bei Frauen zur Bestimmung ihres biologischen Alters unerlässlich. So entspricht z. B. das biologische Gefäßalter einer 50-Jährigen durchaus dem einer 80-Jährigen, wenn sie bereits mit 30 Jahren vorzeitig in die Menopause übergetreten ist (z. B. Ovarektomie) und damit nicht vergleichbar mit einer Frau, die erst mit Ende 50 postmenopausal wird. Es ist anzunehmen, dass sich hormonbedingt unterschiedliche pathophysiologische Prozesse auf Koronarebene abspielen. Der Effekt von Östrogen ist dabei wenig ganzheitlich biologisch und physiologisch erforscht. Fest steht, dass Frauen vor der Menopause selten klinisch symptomatische Atherosklerose entwickeln. Östrogen hat eine schützende, antioxidative und entzündungshemmende Rolle für Gefäßstrukturen, die die Proliferation glatter Muskelzellen und die Matrixablagerung hemmen, die NO-Produktion und -Freisetzung erhöhen und die Endothelreparatur fördern [19]. Andererseits gibt es auch möglicherweise nachteilige Effekte durch einige Östrogenrezeptoren [20]. Dieser prämenopausal protektive Effekt von endogenem Östrogen konnte in der oralen Einnahme postmenopausal nicht gezeigt werden, die postmenopausale Substitutionstherapie ist derzeit nicht empfohlen, insbesondere nicht als sekundärpräventive Gabe bei koronarer Herzerkrankung (KHK) [21].
Koronare Herzerkrankung bei Frauen – ein einzigartiger ischämischer Phänotyp
Anatomisch unterscheidet sich das mit 250 g im Durchschnitt um rund ein Viertel leichtere Frauenherz in seiner anderen Mikroarchitektur durch kleinere, zartere Herzkranzgefäße. Der Herzmuskel selbst ist steifer und weniger elastisch, ein Umstand, der bei älteren Frauen häufiger zu einer diastolischen Herzinsuffizienz führt (HFpEF). Bei kleinerem Gefäßdurchmesser mit geringerem Blutvolumen haben Frauen einen höheren myokardialen Blutfluss, sodass die koronare Flussreserve ähnlich ist. Hierdurch kommt es zu erhöhten Scherkräften am Endothel, ein rheologischer Unterschied, wodurch im jungen Alter weniger Lipideinlagerungen in der weiblichen Gefäßwand auftreten. Es ist somit nicht nur einfach eine kleinere Version des männlichen Herzens [22]. Diese geometrischen Unterschiede wirken sich später auch auf die Pathophysiologie aus. Dem Myokardinfarkt geht die KHK ca. 10 Jahre voraus, die durch Atherosklerose an den Herzkranzgefäßen entsteht [23–25].
Fast zwei Drittel aller Frauen mit Angina pectoris Symptomatik haben keine Obstruktion in der Koronarangiographie [26]. Nichtsdestotrotz wurden bei 46 %–79 % der Frauen mit Koronarstenosen < 50 % atherosklerotische Plaques in der intrakoronaren Bildgebung nachgewiesen [27–28]. Intrakoronare Bildgebung kann helfen, eine Diagnose zu stellen, wenn in der Koronarangiographie zunächst kein wegweisender Befund vorliegt. Bei der Diagnostik der KHK ist die Detektion sogenannter atherosklerotischer vulnerabler Plaques mit hoher Auflösung vor allem durch intrakoronare Bildgebung möglich. Hierzu steht zurzeit hochauflösend vor allem die optische Kohärenztomographie (OCT) zur Verfügung. Mit einer Auflösung von 10–15 µm gelingt eine detaillierte Darstellung des Aufbaus und der Struktur der koronaren Gefäßwand, wodurch eine morphologische Analyse der atherosklerotischen Läsion detailliert ermöglicht wird [29–30]. Studien haben gezeigt, dass das Geschlecht Einfluss auf die Progression der Atherosklerose und die Plaquepathologie hat. Hierbei zeigte sich ein Wechsel in der Koronarpathologie der jungen Frau, bei der häufiger eine Plaqueerosion im Vergleich zur postmenopausalen älteren Frau vorliegt, bei der die Plaquevulnerabilität zunimmt und es zu einem Wechsel des Plaquephänotypen mit überproportionalem Anstieg von Plaquerupturen kommt [31–32]. Studien konnten nun auch durch die weniger invasive Computertomographie atherosklerotische Plaques und ihre hervorgerufene Entzündungsreaktion darstellen, sodass die Bildgebung zukünftig möglicherweise zur Risikostratifizierung von Frauen dienen kann [33].
Trotz des verbesserten Verständnisses für Koronarläsionen dank intrakoronarer Bildgebung ist die Arbeitsdiagnose myocardial infarction with no obstructive coronary artery disease, kurz „MINOCA“, noch in einer großen Gruppe unterschiedlichster Pathomechanismen zusammengefasst, was zeigt, dass unser Verständnis für die dort vorherrschende Ischämie immer noch nur in Teilen verstanden ist. Hauptdifferenzialdiagnosen des weiblichen Brustschmerzes sind die Takotsubo-Kardiomyopathie (Broken-Heart-Syndrom), die Spontandissektion (SCAD) und die Mikrozirkulationsstörung. Frauen sind von dem Phänomen „MINOCA“ doppelt so häufig betroffen. Bei nicht obstruktiver KHK und unauffälliger intrakoronarer Bildgebung sollte daher eine Testung auf eine mikrovaskuläre Dysfunktion erfolgen. In den neuen Leitlinien des ESC wurde der erweiterten Diagnostik zur funktionalen Testung mittels Druckdrahtmessung zur Messung der Koronarflussreserve (CFR) und des Index des Mikrozirkulationswiderstands (IMR) für den Nachweis einer mikrovaskulären Zirkulationsstörung inzwischen ein großer Stellenwert eingeräumt, der hoffentlich mehr Frauen damit Zutritt zur präziseren Diagnosestellung ermöglicht. Unterschieden werden die endotheliale Dysfunktion, die mikrovaskuläre Angina, die vasospastische Angina und die geminderte Vasodilatation, die jeweils gezielt mit Calciumantagonisten, Nitraten, Betablockern oder einer Kombinationstherapie behandelt werden [34].
Kardiovaskuläre Risikofaktoren
Bei den Risikofaktoren für eine KHK ist es wichtig, zwischen den traditionellen und geschlechtsspezifischen Risikofaktoren zu unterscheiden. Zudem hat sich gezeigt, dass bestimmte klassische Risikofaktoren für Frauen ein größeres Gewicht haben als für Männer, also gravierender sind, wenn sie bei Frauen auftreten als bei Männern. Hierzu zählen insbesondere das Rauchen und der Diabetes mellitus, die eine höhere Gewichtung bei Frauen haben. Insbesondere Diabetes mellitus erhöht das kardiovaskuläre Risiko bei Frauen um das Drei- bis Fünffache. Raucherinnen haben ein 25 % erhöhtes Risiko im Vergleich zu Männern [35, 36]. Autoimmunerkrankungen, eine heterogene Gruppe von Erkrankungen mit chronischer systemischer Inflammation, treten bei Frauen häufiger auf und führen zur einer vorzeitigen Atherosklerosemanifestation [37]. Gleichzeitig erreichen Frauen in der Primär- bzw. Sekundärprophylaxe seltener Blutdruck- und Cholesterinzielwerte und bekommen seltener hierfür eine medikamentöse Therapie verschrieben. Dabei gibt es gute Daten, dass die low-density Lipoprotein (LDL)-Cholesterin-Senkung ebenso bei Frauen eine wichtige Rolle spielt und medikamentöse Therapien hierfür bei ihnen wirksam sind. Außerdem steigen die Blutfette (Triglyceride, Gesamtcholesterin, Lipoprotein a) nach der Menopause an [38–39].
Geschlechtsspezifische Risikofaktoren: Frau ist nicht gleich Frau
Wichtig ist sich klarzumachen, dass die Frau Zeit ihres Lebens hormonbedingt speziellen geschlechtsspezifischen Risikofaktoren ausgesetzt ist. In jeder Lebensphase gibt es geschlechtsspezifische Risikofaktoren, auf die geachtet werden sollte. Mehrere Studien haben in den letzten Jahren gezeigt, dass neben den traditionellen Risikofaktoren die geschlechtsspezifischen Risikofaktoren eine erhebliche Rolle spielen. Diese werden aber im klinischen Alltag von Ärzten nicht routinemäßig abgefragt, obwohl sie einen wichtigen Baustein zur Risikostratifizierung darstellen. Bei jungen Frauen steht zunächst das polyzystische Ovar (PCOS) als Risikofaktor im Vordergrund, das die häufigste Hormonstörung in der prämenopausalen Phase darstellt. PCOS ist assoziiert mit Diabetes mellitus Typ II und einer erhöhten Myokardinfarktrate [40].
Als wichtige geschlechtsspezifische Risikofaktoren haben sich während der Schwangerschaft hypertensive Schwangerschaftserkrankungen (HDP hypertensive disorders of pregnancy) herausgestellt. Hierzu gehören der chronische Hypertonus, der in der Schwangerschaft aggraviert, die Präeklampsie, die Eklampsie und das HELPP Syndrom. Die Präeklampsie tritt in 5–10 % aller Schwangerschaften auf, das Risiko, eine KHK im Leben zu entwickeln, steigt in dieser Gruppe dramatisch auf das Vier- bis Fünffache an [41]. Nach der Entbindung gerät die Erkrankung allerdings bei inzwischen wieder normotensiven Blutdruckwerten oft bei der Betroffenen selbst in Vergessenheit. In Deutschland sucht man vergeblich nach einem strukturiertem Nachsorgeprogramm für die Frauen, die sowohl vom gynäkologischen Aspekt als auch dringend internistisch gemonitort werden müssten. Insgesamt liegt auch international das Follow-up dieser Frauen bereits nach sechs Monaten nur noch bei 58 %, und damit ist eine Chance verpasst, kardiovaskuläre Risikofaktoren rechtzeitig zu erkennen und zu therapieren [42].
Neben den hypertensiven Schwangerschaftserkrankungen ist der Gestationsdiabetes ein eigener kardiovaskulärer Risikofaktor mit einer 35–60 %-igen Wahrscheinlichkeit, später einen Diabetes mellitus zu entwickeln. Betroffene Frauen haben somit ein erhöhtes Risiko für eine spätere KHK [43–44]. Des Weiteren sind auch Fehlgeburten mit einem erhöhten kardiovaskulären Risiko assoziiert bzw. betroffene Frauen entwickeln mehr kardiovaskuläre Risikofaktoren, hierzu gibt es allerdings nur unzureichende Daten und die Mechanismen sind nicht hinreichend bekannt [45].
| Tabelle 3: Übersicht der kardiovaskulären Risikofaktoren bei Frauen | |
| Traditionelle Risikofaktoren | |
| Pos. Familienanamnese | |
| Art. Hypertonus | Frauen haben einen schlechter kontrollierten Blutdruck, nach der Menopause ↑↑ |
| Hyperlipidämie | erreichen seltener LDL-Zielwerte nach der Menopause ↑↑ |
| Diabetes mellitus | 45 % erhöhte Risiko für CVD |
| Rauchen | 25 % erhöhtes Risiko für CVD |
| Adipositas | Höheres Risiko bei Frauen |
| Geschlechtsspezifische Risikofaktoren | |
| Anzahl Schwangerschaften/Geburten | Fehlgeburt, Frühgeburt |
| Hypertensive Schwangerschafts- erkrankungen | |
| Gestationsdiabetes | |
| Frühe Menopause | |
| Polyzystisches Ovar | |
| Mammakarzinom | |
| Hormoneinnahme | Konzeptionelle Verhütung |
| Autoimmunerkrankungen | |
Das Eintreten der Menopause bei Frauen unter 45 Jahren wird als früh, unter 40 Jahren als vorzeitig, definiert. Eine frühe Menopause tritt hierbei in 10 % der Fälle, eine Menopause unter 40 Jahren in 1 % der Fälle auf. Hierbei mag es, wie oft in der Medizin, sinnvoller sein, statt eines strengen cut offs, die Altersspanne von 40–45 zu betrachten. Der Hauptgrund für das erhöhte kardiovaskuläre Risiko mit erhöhtem Auftreten von Myokardinfarkten wird in dem frühen Verlust des protektiven endogenen Östrogens gesehen sowie einer entsprechenden Erhöhung der Androgene. Dies führt zu einer erheblich rascheren Entwicklung von Hypercholesterinämie, arterieller Hypertension und Diabetes mellitus. Die frühe Menopause stellt neben der erhöhten Gefahr für eine schnellere Entwicklung von traditionellen Risikofaktoren laut Studien auch einen unabhängigen kardiovaskulären Risikofaktor dar [46].
Viele Frauen nehmen Hormone, ob zu kontrazeptionellen Zwecken oder als postmenopausale Einnahme, nicht unbedingt als Medikamenteneinnahme wahr. Die Einnahme von Hormonpräparaten sollte daher bei der kardiologischen Anamnese explizit erfragt werden.
Weitere Herausforderungen: Transgender erhöht Myokardinfarktrate
Der Einfluss von Hormonen ist durch übergeordnete Regelkreisläufe komplex und unverstanden, noch komplizierter ist die orale Einnahme von Sexualhormonen, die sonst einem hoch spezialisierten Zyklus unterworfen sind. Transgenderpersonen rücken zunehmend in den klinischen Alltag der ärztlichen Versorgung. Studien haben gezeigt, dass sie ein erhöhtes kardiovaskuläres Risiko und erhöhte Mortalität im Vergleich zur Durchschnittsbevölkerung aufweisen. Im direkten Vergleich haben Transfrauen ein schlechteres Outcome als Transmänner. Auch haben Studien gezeigt, dass allgemein die Progression der Atherosklerose und die Plaquepathologie des Myokardinfarkts bei Frauen und Männern unterschiedlich sind. Daten bzgl. Herzerkrankungen von Transgender-Personen, die eine geschlechtsangleichende Hormontherapie (GAHT) erhalten haben, sind begrenzt. Die Einnahme von Testosteron war bei Transmännern mit erhöhten Blutfett- und Blutdruckwerten verbunden. Eine Östrogentherapie hingegen führte bei Transfrauen zu einer Senkung von Blutfetten und Blutdruck, paradoxerweise stieg jedoch die Myokardinfarktrate an. Gleichzeitig war das Thromboserisiko bei Transfrauen höher als bei Cisfrauen [47–49]. Kürzlich konnte gezeigt werden, dass bei Personen, die eine GAHT einnehmen, regulatorische Veränderungen in der Immunantwort durch Sexualhormone auftreten [50]. Bisher ist unklar, inwiefern die Einnahme von Sexualhormonen die Atherosklerose bei Transgenderpersonen beeinflusst und akzeleriert, und inwiefern das jeweilige Geschlecht die Atherogenese und den atherosklerotischen Phänotyp bestimmt.
Fazit
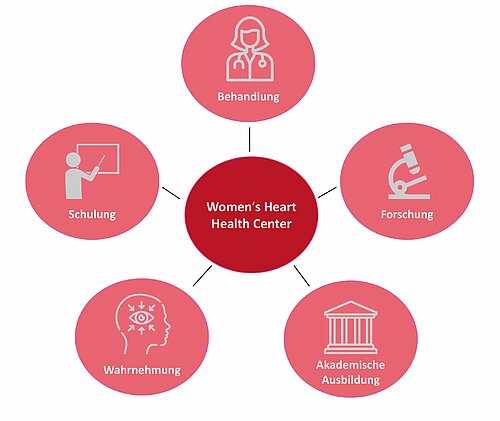
Maßnahmen zur verbesserten Versorgung in Deutschland – Women’s Heart Center
Verglichen mit Männern präsentieren sich Frauen mit einer größeren Fülle an Symptomen. Frauen erhalten seltener eine leitliniengerechte Therapie, auch noch im Jahr 2025. Eine erhebliche Reduktion der Mortalität kardiovaskulärer Erkrankungen konnte speziell in den USA erfolgen – dank eines größeren Bewusstseins und einer stärkeren Fokussierung auf Frauen und deren geschlechtsspezifisches Risiko [51]. Dies wurde insbesondere durch die Etablierung sogenannter Women’s Heart Center erreicht, interdisziplinäre Zentren spezialisiert auf kardiale Erkrankungen bei Frauen, um hier leitliniengerechte Therapie bei Frauen gleichermaßen wie bei Männern anzuwenden und um auf geschlechtsspezifische Risikofaktoren und Bedürfnisse eingehen zu können. Wollen wir das Outcome in Deutschland verbessern, sollten auch wir in Deutschland solche Zentren flächendeckend in der modernen Medizin etablieren. Wenn wir das Outcome verbessern möchten, ist es entscheidend, das Bewusstsein bei Patienten sowie medizinischem Personal zu schärfen. Geschlechtsspezifische Risikofaktoren bei Frauen während der Schwangerschaft und der Menopause müssen hierbei stärker in den Mittelpunkt rücken.
Zur Verbesserung der medizinischen Versorgung bei Frauen sollte der Fokus stärker auf die Erstellung eines individuellen Risikoprofils unter Berücksichtigung des Alters und der individuellen geschlechtsspezifische Risikofaktoren gelegt werden. Nur so können weiterführende Tests (Koronar-Computertomographie CT, Kardio-Magnetresonanztomographie MRT etc.) sinnvoll eingesetzt werden. Die aktuellen Versorgungsleitlinien der ESC haben zwar geschlechtsspezifische Risikofaktoren erstmals in den neuen Leitlinien zum chronischen Koronarsyndrom erwähnt, aber hieraus noch keine Risikostratifizierung und Empfehlung der entsprechenden Therapie (individuelle Ziel-LDL-Cholesterinwerte) und Diagnostik abgeleitet. In Deutschland existieren bisher keinerlei geschlechtssensitive Versorgungsangebote. Bzgl. der diesen Unterschieden zugrundeliegenden pathophysiologischen Besonderheiten gibt es keine hinreichenden Daten, sodass eine individuelle, auf Frauen zugeschnittene Therapie und Präventionsstrategie aktuell nicht möglich ist. Wie die USA gezeigt haben, können spezielle Frauenherzzentren hierfür einen wichtigen Beitrag leisten, das Outcome und die medizinische Versorgung bei Frauen zu verbessern. Bis 2030 sollte es auch innerhalb ganz Deutschland möglich sein, den Lancet Global burden zu reduzieren.
Dr. med. Lena Marie Seegers, Medizinische Klinik 3, Kardiologie und Angiologie, Women’s Heart Health Center Frankfurt, Johann Wolfgang-Goethe-Universität, Frankfurt am Main, E-Mail: lena.seegers@herz-frankfurt.de
Die Literaturhinweise finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Frauenherzen, ein einzigartiger ischämischer Phänotyp/Warum Frauen anders krank werden“ von Dr. med. Lena Marie Seegers finden Sie im Portalsowie in der PDF-Version dieses Artikels.
Die Teilnahme zur Erlangung von Fortbildungspunkten ist nur online über das Portal vom 25.01.2025 bis 24.07.2025 möglich. Die Fortbildung ist mit drei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autorin sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring und es bestehen keine Interessenkonflikte. (red)
| Abkürzungsverzeichnis | |
| AHA | American Heart Association |
| ASS | Acetylsalicylsäure |
| CFR | Koronarflussreserve |
| CVD | cardiovascular disease, Herz- Kreislauf-Erkrankungen |
| ESC | European Society of Cardiology |
| GAHT | geschlechtsangleichende Hormontherapie |
| HDP | hypertensive disorders of pregnancy |
| HELPP- Syndrom | Akronym aus: Haemolysis Elevated Liver enzymes Low Platelet count, schwerwiegende Variante der Präeklampsie |
| HFpEF | Heart Failure with preserved Ejection Fraction, diastolische Herzinsuffizienz |
| IMR | Mikrozirkulationswiderstand |
| KHK | koronare Herzerkrankung |
| LAD | linke vordere Herzkranz- arterie |
| LDL | low-density Lipoprotein |
| MINOCA | myocardial infarction with no obstructive coronary artery disease |
| NO | Stickstoffmonoxid |
| OCT | optical coherence tomography, optische Kohärenztomographie |
| PCI | perkutane Koronarintervention |
| PCOS | polyzystisches Ovar |
| SCAD | spontaneous coronary artery dissection, Spontandissektion |
| STE-ACS | ST Elevation Acute Coronary Syndrome: alle akuten Koronarsyndrome, die im EKG signifikante ST-Strecken-Hebungen aufweisen |
| STEMI | ST-Hebungsinfarkt |