Dr. med. Anastasia Falagkari
Ein Abkürzungsverzeichnis befindet sich im Literaturverzeichnis.
Einleitung
Die kardiale Ablation hat sich in den vergangenen Jahrzehnten zu einer der wichtigsten therapeutischen Optionen für Patienten mit Herzrhythmusstörungen entwickelt. Diese Technik hat im Verlauf der Zeit das Management von atrialen und ventrikulären Arrhythmien revolutioniert; durch das hohe Sicherheitsprofil sowie bei stets steigender Effektivität ist eine Ablation für viele Patienten eine bessere Alternative zu einer medikamentösen Therapie zur Besserung der Prognose und/oder der Lebensqualität. In diesem Artikel werden historische Entwicklungen, technische Aspekte, Indikationen, Risiken und Herausforderungen der kardialen Ablation beleuchtet.
Therapieprinzip, Setting und Risiken
Ziel der Ablation ist die Modifikation der elektrischen Eigenschaften bis hin zum irreversiblen Tod von Zellen, die Arrhythmiefoci bilden. Arrhythmien können in Gruppen von Myozyten durch eine abnormale Impulsinitiierung entstehen, die der physiologischen Automatik von Schrittmacherzellen (Sinus- und AV-Knoten) ähnelt und als gesteigerte Automatie bezeichnet wird. Ein weiterer Mechanismus betrifft die frühen oder späten Nachdepolarisationen (early afterdepolarisation EAD, late afterdepolarisation DAD) und beinhaltet Oszillationen des Membranpotenzials; die daraus resultierenden Arrhythmien werden als getriggerte Aktivität beschrieben. In Gegensatz zu diesen Mechanismen, die fokale Tachykardien bilden, entstehen Makro-Reentry-Tachykardien in anatomischen Regionen, wo das Zusammenspiel von erregbaren und refraktären Kardiomyozyten einen funktionellen Kreis der kontinuierlichen Erregung bildet.
Was Ablationskomplikationen angeht, können diese nach Ort der Entstehung und nach Schweregrad unterteilt werden (Tab. 1.) und sind von der Lokalisation des Ablationsziels und der angewandten Methode abhängig.
| Tab. 1: Allgemeine Komplikationen bei kardialen Ablationen, nach [1] | ||
| Beschreibung | Rate | |
| Vitale Komplikationen | Tod | < 0,2 % |
| Atrioösophageale Fistel | < 0,4 % | |
| Stroke/TIAa | < 1 % | |
| Perikardtamponade | < 0,5-1 % | |
| Major Komplikationen | Pulmonalvenenstenose | < 1 % |
| Persistierende Phrenikus-Parese | 1-2 % | |
| Major vaskuläre Komplikationenb | 2-4 % | |
| Minor Komplikationen | Perikarditis | 0,7 % |
| Unklare Signifikanz | Asymptomatische zerebrale Embolien (silent stroke) | 5–10 % |
| Röntgen-Exposition | 3–12 mSV | |
| a TIA: transitorisch ischämische Attacke b Vaskuläre Komplikationen: die einer interventionellen oder chirurgischen Therapie bedürfen. | ||
Geschichte der Ablation
Die erste kardiale Katheterablation geschah 1979 durch einen Unfall: Im Labor für die Elektrophysiologische Untersuchung (EPU) des französischen Kardiologen Guy Fontaine führte ein versehentlicher Kontakt einer Katheterelektrode mit der Defibrillationselektrode während einer Defibrillation zu einem kompletten AV-Block. 1985 führte der Ingenieur Dr. Peter Osypka Hochfrequenzstrom als Energiequelle für Ablationen ein. Dieser erzeugt durch Widerstandswärme Nekrosen im Myokard. In den 1990er-Jahren wurde die Radiofrequenzablation (RFA) zum Standard bei verschiedenen Herzrhythmusstörungen. Ultraschall- und Laserenergie etablierten sich nicht wegen ungünstiger Effektivität und Risiken. Dagegen gewann die Kryoablation, bei der extreme Kälte Zellschäden durch Eiskristalle verursacht, an Bedeutung. Eine Erweiterung, die ultra-low temperature cryoablation (ULTC), nutzt Temperaturen bis -180°C für tiefere Läsionen.
Die modernste Methode ist die gepulste Feldablation (PFA), ursprünglich aus der Onkologie. Es ist die einzige Methode, bei der nicht-thermische Energie genutzt wird, um Läsionen im Myokardgewebe zu erzeugen. Es werden serielle elektrische Impulse (1.500–2.000 Volt) angewendet, die durch Elektroporation den Zelltod gezielter Kardiomyozyten herbeiführen, ohne umliegendes Gewebe zu schädigen. Die PFA kann mittlerweile mit Hilfe von speziellen Adaptern über konventionellen RF-Kathetern für punktuelle Ablationen mit 19–25 Ampere eingesetzt werden.
Spezifische elektrophysiologische Behandlung von Arrhythmien
Sinusknoten-Reentry und inadäquate Sinustachykardie
Eine Sinusknoten-Reentry-Tachykardie entsteht durch einen Reentry-Kreislauf und äußert sich in paroxysmalen Tachykardieepisoden. Im EKG zeigen die P-Wellen eine Polarität und Form, die denen der normalen Sinus-P-Wellen ähneln. Die Diagnose wird anhand von Ruhe-EKG und Holter-EKG vermutet und kann durch eine EPU bestätigt werden. Die medikamentöse Behandlung basiert auf empirischen Ansätzen, da keine kontrollierten Studien zu spezifischen Medikamenten vorliegen. Eine effektive und sichere Behandlungsmöglichkeit bietet die Katheterablation mit einer ESC-Klasse IIa-Indikation [1], die auf den Punkt der frühesten atrialen Aktivierung in Bezug auf die P-Welle abzielt.
Eine inadäquate Sinustachykardie definiert sich als ein Sinusrhythmus mit Herzfrequenz > 100 Schläge/min (bpm), die sich nicht proportional zum gegebenen physikalischen, emotionalen oder medikamentösen Stress verhält. Betroffen sind meistens junge Frauen. Der zugrunde liegende Mechanismus ist multifaktoriell (z. B. Dysautonomie, neurohormonelle Dysregulation, intrinsische Sinuskontenhyperaktivität) und wurde noch nicht komplett verstanden. Die Prognose ist zwar gut und das Risiko für eine Tachymyopathie gering, aber die betroffenen sind häufig hoch symptomatisch mit anhaltenden Palpitationen, Dyspnoe und Belastungsintoleranz. Die Diagnose erfolgt nach Ausschluss von orthostatischer, Sinus-Reentry und fokalen Tachykardien aus der christa terminalis oder der rechten oberen Pulmonalvene (ähnliche p-Wellen-Konfiguration). Die medikamentösen Therapiemöglichkeiten sind relativ begrenzt. Beta-Blocker und Kalziumkanal-Blocker von nicht-Dihydropyridin-Typ können zwar erwogen werden, sind aber mit Hypotonien und chronischer Müdigkeit verbunden. Ivabradin ist ein selektiver Blocker der IF-Kanäle (regulieren den „Schrittmacherstrom“) im Sinusknoten und ist sicher und gut verträglich.
Invasiv kann bei Versagen der medikamentösen Therapie und bei hohem Leidensdruck eine Modulation des Sinusknoten erwogen werden. Allerdings ist das Ablationsergebnis häufig suboptimal aufgrund der epikardialen Lokalisation des Sinusknotens und des hohen Schrittmacherrisikos.
Fokale atriale Tachykardien (FAT)
Der Mechanismus ist eine gesteigerte Automatie oder getriggerte Aktivität von Myozyten. Der organisierte Vorhofrhythmus (meist > 100 bpm) hat einen diskreten Ursprung und breitet sich zentrifugal über beide Vorhöfe aus. Die EKG-Interpretation kann manchmal sehr anspruchsvoll sein, insbesondere wenn die P-Wellen in den QRS-Komplexen oder T-Wellen verborgen sind. Die P-Wellen sind in der Regel monomorph mit einer stabilen Zykluslänge und haben häufig ein dazwischenliegendes isoelektrisches Intervall. Die P-Wellenmorphologie kann dabei helfen, den Tachykardie-Exit abzuschätzen. Am häufigsten entstehen FAT an der christa terminalis, am Ostium des Coronarsinus oder entlang des Trikuspidal- und Mitralanulus [2]. Eine Unterscheidung zwischen fokalen und makro-Reentry-Arrhythmien mittels Oberflächen-EKG ist jedoch nicht immer möglich. Das Vorhandensein einer isoelektrischen Linie schließt einen Makro-Reentry-Mechanismus nicht aus, insbesondere bei vernarbten Vorhöfen. Beta- und Kalziumkanalblocker terminieren die Tachykardie oder verlangsamen die ventrikuläre Frequenz. Auch Arzneimittel der Klassen IA, IC und III können wirksam sein, indem sie die Automatie unterdrücken [3]. Adenosin terminiert häufig fokale Tachykardien, die durch getriggerte Aktivität bzw. DADs entstehen.
Die Katheterablation ist die Behandlung der Wahl (ESC Klasse IB-Indikation) bei rezidivierender FAT, insbesondere wenn sie anhaltend ist, weil darunter ein hohes Risiko für eine Tachymyopathie besteht. Die Katheterablation wird mittels RF oder fokaler PFA durchgeführt und die Erfolgsquote beträgt 75–100 % [4].
AV-Knoten-Reentry-Tachykardien (AVNRT)
Die AVNRT ist eine der häufigsten Formen der paroxysmalen supraventrikulären Tachykardien, die besonders bei jungen Erwachsenen ab der 4. Lebensdekade auftritt und durch einen reentry-Schaltkreis, im atrioventrikulären-Knoten (AVN) gekennzeichnet ist. Die typische Form der Tachykardie ist die „slow-fast“ AVNRT, eine Schmalkomplex-Tachykardie. Durch die schnelle retrograde Leitung sind die retrograden P-Wellen meistens sehr nah oder sogar in den QRS-Komplexen verborgen. Wenn sie gesehen werden, dann sind sie in den inferioren Ableitungen II, III, aVF negativ und positiv in der präkordialen Ableitung V1 und bewirken somit ein pseudo-S in den inferioren Ableitungen und ein pseudo-R in V1. In der atypischen Variante der AVNRT („fast-slow“, ca. 6 % der AVNRT [5]) die auch als „long-RP-Tachykardie“ gekennzeichnet wird, sind die retrograden P-Wellen besser zu beurteilen, da sie außerhalb der QRS-Komplexen einfallen.
Patienten mit AVNRT zeigen typischerweise Episoden mit abrupt einsetzenden und endenden (on-off-Phänomen) Episoden, die Palpitationen, Schwindel, Harndrang, Pochen im Hals und selten Synkopen verursachen können. Akute Episoden können oft mit dem Valsalva-Manöver, Trinken von kaltem Wasser oder mit der Karotissinusmassage beendet werden. Unter Gabe von 12–18 mg Adenosin intravenös (i.v.) kommt es zu einer abrupten Terminierung der Tachykardie. Die chronische Verabreichung von Verapamil, Diltiazem oder Metoprolol verringert die Häufigkeit und Dauer von AVNRT, hat aber eine variable Erfolgsquote, die zwischen 13 und 82 % liegt [6]. Daher hat sich bei symptomatischen Patienten mit rezidivierenden Tachykardien die Katheterablation als first-line Therapie mit einer ESC-Indikation IB etabliert. Ziel der Prozedur, die mittels RF durchgeführt wird, ist die Modifikation oder Ablation des slow pathways. Die Lokalisation der langsamen AV-nodalen Bahn ist im Dreieck von Koch, welches von den Todaro-Sehnen, dem Ostium des Koronarsinus und den septalen Segmenten der Trikuspidalklappe eingegrenzt wird. Der Erfolg bei einer AVNRT-Ablation beträgt 97 % mit einem Risiko für totalen AV-Block von < 1 %, welcher höher ist für Patienten mit einem bereits existierenden AV-Block I° [7, 8]. Die Kryoablation birgt zwar ein geringeres Risiko für einen AV-Block III°, ist aber mit einer deutlich höheren Rezidivrate verbunden [9].
AV-Reentry-Tachykardie (AVRT) und WPW
Analog zur AVNRT können auch beim Vorhandensein von akzessorischen Bahnen (accessory pathway AP) Reentry-Kreisläufe entstehen. Das Reentry besteht aus zwei Gliedmaßen: dem AVN und der AP. Die entstehende Tachykardie kann in zwei möglichen Richtungen kreisen: orthodrom (häufigste Form, 90 %) mit atrioventrikulärer Ausbreitung über den AV-Knoten und ventrikuloatrialer Rückkopplung über die akzessorische Bahn oder umgekehrt antidrom (selten, ca. 8 % [10]). In seltenen Fällen bestehen zwei oder mehr APs, die das Reentry unterhalten können ohne Mitwirkung des spezifischen Reizleitungssystems. APs sind einzelne oder mehrere Stränge von Myokardzellen, die das physiologische Leitungssystem umgehen und das atriale und ventrikuläre Myokard direkt verbinden. Es gibt zwar verschiedene Arten von APs, aber die häufigsten sind diejenigen, die den Vorhof und den Ventrikel entlang des lateralen Mitral- (60 %) oder Trikuspidalringes (25 %) verbinden [11]. Sie weisen typischerweise eine schnelle, nicht-dekrementale, häufig bidirektionale Leitung auf. Bei einer antegraden Leitung ist die Präexzitation in Ruhe-EKG in Sinusrhythmus als „delta-Welle“ erkennbar und die AP wird als manifest bezeichnet im Gegensatz zu den verborgenen Bahnen, die ausschließlich retrograd leiten.
Das bekannteste Arrhythmiesyndrom, das mit einer manifesten akzessorischen Leitungsbahn verbunden wird, ist das Wolff-Parkinson-White-Syndrom (WPW). Pathognomonisch im Ruhe-EKG ist ein kurzes PQ-Intervall < 120 ms und eine QRS-Verbreitung > 120 mg, die durch eine Delta-Welle entsteht. Die Symptomatik der Tachykardie-Episoden ist ähnlich wie bei Patienten mit AVNRT, allerdings sind die Patienten mit AVRT meist jünger (< 40 J). Das Anfalls-EKG zeigt eine regelmäßige Tachykardie mit schmalen QRS-Komplexen und häufig sichtbaren retrograden P-Wellen im Fall einer orthodromen oder breiten QRSs bei einer antidromen Tachykardie.
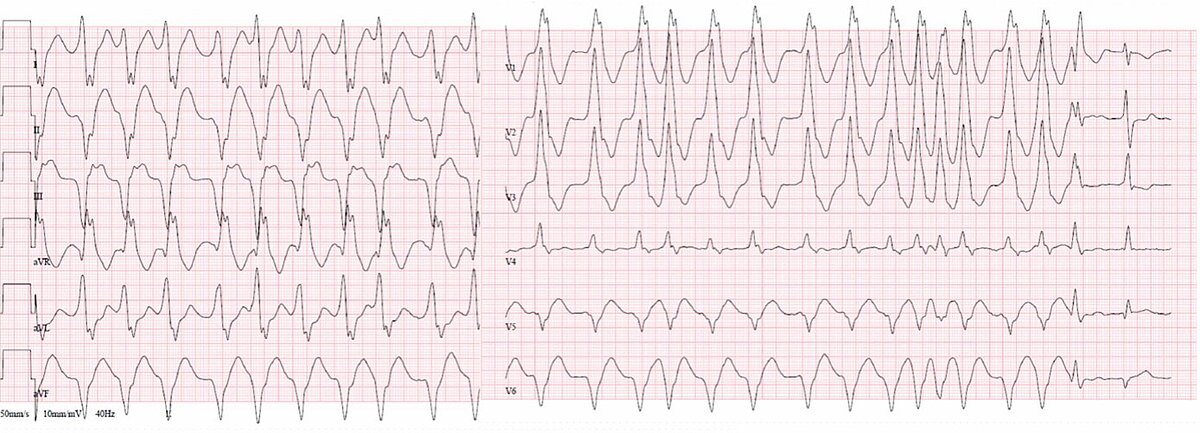
Während der orthodromen AVRT kann die medikamentöse Therapie auf eine der Komponenten des Schaltkreises gerichtet werden, das AVN (Betablocker, Diltiazem, Verapamil) oder die AP (Propafenon oder Flecainid). Die antidrome AVRT ist aufgrund einer sehr schnell leitenden AP mit dem malignen WPW-Syndrom assoziiert und Medikamente, die hauptsächlich auf die AP wirken, sollten bevorzugt werden. Paroxysmales Vorhofflimmern hat eine Inzidenz von bis zu 50 % bei Patienten mit WPW und kann in seltenen Fällen die Erstdokumentation des Syndroms sein [12]. Die Kombination von Vorhofflimmern und einer antegrad leitenden AP mit kurzer Refraktärzeit kann zu lebensbedrohlichen Situationen führen: es entsteht eine FBI-Tachykardie (Fast, Broad, Irregular, Abb. 1), die bis zu Kammerflimmernn eskalieren kann und mittels Notfall-Elektrokardioversion oder Klasse-I-Antiarrhythmika terminiert werden muss. Adenosin oder weitere Antiarrhythmika, die den AVN verlangsamen, sind in diesem Fall kontraindiziert.
Die Behandlung der Wahl für Patienten mit symptomatischer und rezidivierender AVRT ist die Katheterablation (ESC Klasse IB-Indikation). Bei asymptomatischer Präexzitation soll bei einem Hochrisikoberuf (z. B. Pilot, Sportler) eine invasive Risikostratifikation im Sinne einer EPU ebenso mit einer ESC Klasse IB-Indikation erfolgen. Bei kurzer Refraktärzeit und schnellen Leitungseigenschaften der AP empfiehlt sich eine Ablation in gleicher Sitzung (ESC Klasse IC-Indikation).
Die AVRT-Ablation hat eine hohe akute Erfolgsrate und ist je nach Lokalisation der AP mit einer niedrigen Komplikationsrate verbunden. Zu den wichtigsten Komplikationen gehören eine Perikardtamponade (0,13–1 %) für die linkslaterale AP-Lokalisation mit transseptalem Zugang und ein kompletter AV-Block (0,17–2,7 %) bei Patienten, bei denen eine Ablation von septalen APs versucht wird [13]. Die Inzidenz von AV-Block ist unter Kryoablation zwar geringer aber -analog zur AVNRT- mit mehr Rezidiven verbunden [14].
Typisches (isthmusabhängiges) Vorhofflattern
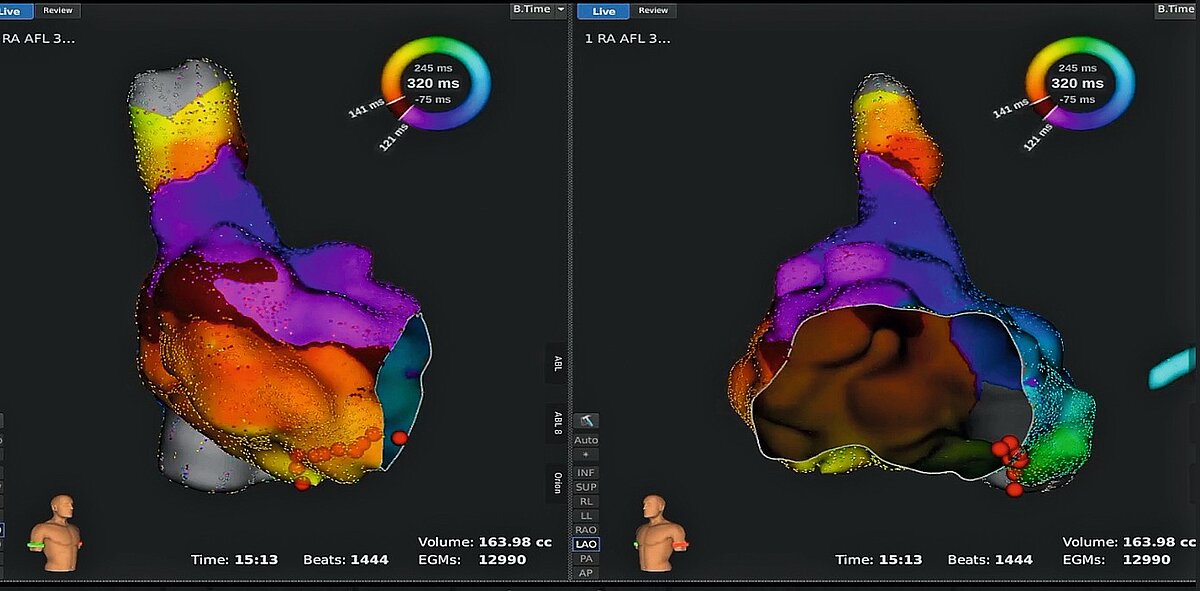
Als typisches Vorhofflattern versteht sich ein Makro-Reentry-Kreislauf im rechten Vorhof bei dem der cavotrikuspidale Isthmus (CTI) als kritischer Isthmus der Tachykardie definiert wird. Die Aktivierungsfront im rechten Atrium (RA) verläuft in zwei möglichen Richtungen: klassischerweise entlang der RA-freien Wand nach kaudal, durch den CTI und über das atriale Septum zurück nach kranial, während die Aktivierung des linken Vorhofs (LA) passiv ist. Diese Aktivierung wird als counterclockwise (CCW, gegen Uhrzeigersinn) Vorhofflattern bezeichnet und führt zu einem typischen Sägezähnen-EKG-Muster mit negativen Flatterwellen in den inferioren Ableitungen und positiven in der Ableitung V1. Die gegenseitige Aktivierung des rechten Vorhofs (Septum-CTI-freie Wand) wird entsprechend als clockwise VorhofFlatter beschrieben. Die Frequenz im Vorhof beträgt ca. 250–300 bpm und hat eine meist 2:1 ventrikuläre Überleitung.
Die medikamentöse Unterbrechung des Reentry-Kreises bei typischem Vorhofflattern ist oft ineffektiv und eine Elektrokardioversion ist meistens notwendig [15, 16]. Die Gabe von Adenosin kann die Flatterwellen demaskieren in Fällen mit 2:1-Überleitung mit der zweiten P-Welle im QRS verborgen.
Die effektivste und nachhaltigste Therapie des typischen Vorhofflatterns mit einer ESC Klasse IA-Indikation ist die CTI-Ablation mit RFA oder PFA (Abb. 2) und resultiert eine Rezidivrate von < 6 % [17] bei einem Mortalitätsrisiko von 0,3 % [18].
Was die Antikoagulation bei Vorhofflattern ohne dokumentiertes Vorhofflimmern angeht, mangelt es an prospektiven, randomisierten Studien (RCT). Daten über das embolische Risiko von Vorhofflattern wurden in der Regel bei gleichzeitigem Vorhofflimmern gewonnen, was eine individualisierte Risikostratifizierung erschwert.
Das „stunning“ des linken Vorhofohrs (LAA) und des linken Vorhofs (LA) scheint zwar im Vergleich zu denen bei Vorhofflimmern geringer zu sein, aber das thromboembolische Risiko eines Vorhofflatterns ist immer noch signifikant [19]. Dies, zusammen mit der Assoziation mit Vorhofflimmern, rechtfertigt eine Thromboseprophylaxe vor allem bei vorhandenen Risikofaktoren.
Vorhofflimmern (VHF)
Vorhofflimmern ist die weltweit häufigste anhaltende Herzrhythmusstörung mit steigender, altersabhängiger Inzidenz. Bis zum Jahr 2050 wird die Zahl der Patienten mit Vorhofflimmern aufgrund der demografischen Alterung in den westlichen Ländern schätzungsweise um 250 % steigen [20]. Die Diagnosestellung eines Vorhofflimmerns bei einem Patienten mit typischen Symptomen z. B. Palpitationen und charakteristischen EKG-Veränderungen (unregelmäßiger Rhythmus, keine P-Wellen) sollte keine herausfordernde Aufgabe sein. Im Zeitalter der „wearables“ gilt ein single-lead EKG von ≥ 30 s als diagnostisches Kriterium und soll eine weitere Stratifizierung des thromboembolischen Risikos triggern.
Als Rhythmuskontrolle bei Patienten mit Vorhofflimmern versteht sich die Wiederherstellung und Unterhaltung eines Sinusrhythmus und kann mittels medikamentöser oder elektrischer Kardioversion, perkutaner, chirurgischer oder hybrid-Ablation erreicht werden. Die frühe Rhythmuskontrolle innerhalb von einem Jahr ab der Erstdiagnose des VHF ist im Vergleich zu einer reinen Frequenzkontrolle überlegen, was die Reduktion von thromboembolischen Komplikationen, kardiovaskulärem Tod und Hospitalisierung für Herzinsuffizienz oder akutes Koronarsyndrom angeht [20].
Mehrere RCTs haben Evidenz für die Katheterablation als first-line-Therapie zur Rhythmuskontrolle bei Patienten mit paroxysmalem Vorhofflimmern erbracht, mit einem ähnlichen Risiko für unerwünschte Ereignisse im Vergleich zu Antiarrhythmika [21–23]. Im Gegensatz dazu ist nicht klar, ob die Erstlinienablation der medikamentösen Therapie bei persistierendem Vorhofflimmern überlegen ist. Eine weitere Indikation für eine Katheterablation besteht für Patienten mit symptomatischen, langen präautomatischen Pausen (Pausen, die nach der spontanen Konversion von Vorhofflimmern in den Sinusrhythmus entstehen), um eine Herzschrittmacher-Implantation zu vermeiden. Die aktuellen ESC-Indikationen für eine Vorhofflimmern-Ablation sind in der Tab. 2 zusammengefasst.
Tab. 2: ESC-Empfehlungen für die Katheterablation von Vorhofflimmern | ||
Empfehlungsgrad | Evidenzlevel | |
Die Katheterablation wird als Erstlinie-Therapie im Rahmen einer Strategie zur Rhythmuskontrolle bei Patienten mit paroxysmalem symptomatischem Vorhofflimmern empfohlen. | I | A |
Die Katheterablation wird bei Patienten mit paroxysmalem oder persistierendem Vorhofflimmern empfohlen, die gegen Antiarrhythmika resistent sind oder diese nicht vertragen. | I | A |
Die Katheterablation kann als Erstlinienoption im Rahmen einer Strategie zur Rhythmuskontrolle bei ausgewählten Patienten mit persistierendem Vorhofflimmern in Betracht gezogen werden. | II b | C |
Eine Katheterablation wird bei Patienten mit Vorhofflimmern und HFrEF* auf dem Boden einer Tachymyopathie empfohlen, um die linksventrikuläre Dysfunktion rückgängig zu machen. | I | B |
Bei Patienten mit Bradyarrhythmie oder Pausen bei der Konversion in Sinusrhythmus sollte eine Katheterablation in Betracht gezogen werden, um die Symptome zu verbessern und die Implantation eines Herzschrittmachers zu vermeiden. | II a | C |
Endoskopische und hybride Ablationsverfahren sollten bei Patienten mit symptomatischem persistierendem Vorhofflimmern, das auf eine Antiarrhythmika-Therapie nicht anspricht, in Betracht gezogen werden. | II a | A |
* HFrEF: Herzinsuffizienz mit eingeschränkter systolischer linksventrikulärer Funktion, nach [24] | ||
Die Pulmonalvenenisolation (PVI) bleibt der Eckpfeiler der Katheterablation für paroxysmales Vorhofflimmern [25], aber die optimale Ablationsstrategie für das persistierende VHF wurde noch nicht einheitlich festgelegt.
Neue Technologien wie z. B. die gepulste Feldablation (PFA) ergänzen etablierte Methoden der PVI wie die Radiofrequenzablation (RFA) und Kryoballon-Ablation (CBA). In einer RCT mit 607 Patienten war die PFA in Bezug auf Wirksamkeit und Sicherheit im Vergleich zur konventionellen Radiofrequenz- oder Kryoballonablation nicht unterlegen [26].
Mehrere Merkmale, einschließlich, aber nicht beschränkt auf den Typ des Vorhofflimmerns (paroxysmal, persistierend, lang-persistierend), die linksatriale Dilatation und das Vorhandensein von atrialer und/oder ventrikulärer Fibrose, könnten die Patientenauswahl verfeinern, um den Outcome der PVI zu maximieren. Eine kurzfristige Behandlung mit Antiarrhythmika der Klasse I oder III für die „blanking-Zeit“ (zwei bis drei Monate nach der Ablation) reduziert frühe Rezidive von Vorhofflimmern hat jedoch keinen Einfluss auf späte Rezidive bzw. klinische Ergebnisse nach einem Jahr.
Bei Patienten mit VHF-Rezidiv sollte eine erneute PVI angeboten werden, wenn nach der ersten Ablation eine Verbesserung der Symptome nachgewiesen wurde. Die Erfahrung des Untersuchers und die Anzahl der jährlich durchgeführten Prozeduren im Ablationszentrum sind von entscheidender Bedeutung, da sie mit geringeren Komplikationsraten und 30-Tage-Mortalität verbunden sind [27].
Die minimalinvasive chirurgische AF-Ablation kann über einen thorakoskopischen Zugang oder durch trockene Perikardpunktion unter dem Xiphoid durchgeführt werden. Es wurden hybride Ablationsverfahren entwickelt, bei denen die endoskopische epikardiale Ablation am schlagenden Herzen in Kombination mit einer endokardialen Katheterablation entweder in einem simultanen oder einem sequenziellen Verfahren stattfindet. Die Rationale für die Kombination eines endokardialen mit einem epikardialen Zugang besteht darin, dass eine effektivere transmurale Läsion erreicht werden kann. Bei paroxysmalem Vorhofflimmern kann nach frustranen perkutanen Ablationsversuchen ein endoskopischer oder hybrider Ablationsansatz in Betracht gezogen werden. Bei lang persistierendem Vorhofflimmern eignen sich endoskopische oder hybride Ablationsansätze sogar als erstes Verfahren, um den Sinusrhythmus bei ausgewählten Patienten langfristig aufrechtzuerhalten.
Es muss betont werden, dass bei allen Patienten mit einem relevanten Thromboembolierisiko die orale Antikoagulation unabhängig vom Rhythmusergebnis dauerhaft fortgesetzt wird.
Fazit
Die kardiale Ablation hat sich zu einem Eckpfeiler in der Behandlung von atrialen Tachykardien entwickelt und bietet für viele Patienten einen kurativen Ansatz und eine oft überlegene Alternative zu einer medikamentösen Therapie. Individuelle Patientenfaktoren darunter Alter, allgemeiner Gesundheitszustand, Art und Schwere der Herzrhythmusstörungen sowie ein gründliches Verständnis des Tachykardiemechanismus definieren den klinischen Outcome. Die Entwicklung neuer Visualisierungs- und Ablationstechnologien bittet zwar zahlreiche Möglichkeiten zur prozeduralen Präzision und Effektivität, erfordert jedoch eine kontinuierliche Weiterbildung, um neue Methoden effektiv in die klinische Praxis zu integrieren. Die Ära der Herzablation in der Behandlungslandschaft für Herzrhythmusstörungen hat begonnen, sie wird verfeinert und zugänglicher und bietet prognostische und symptomatische Besserung für unzählige Patienten, die an Arrhythmien leiden.
Dr. med. Anastasia Falagkari, Universitäres Herz- und Gefäßzentrum, Goethe-Universität Frankfurt, Korrespondenzadresse: anastasia.falagkari@herz-frankfurt.de
Die Literaturhinweise finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Die Ära von kardialen Ablationen: Fokus auf atriale Arrhythmien“ von Dr. med. Anastasia Falagkari finden Sie in der PDF-Version dieses Artkels und im Mitgliederportal unter https://portal.laekh.de.
Die Teilnahme zur Erlangung von Fortbildungspunkten ist nur online über das Portal vom 25.03.2025 bis 24.09.2025 möglich. Die Fortbildung ist mit drei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Der Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autorin sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es gibt kein Sponsoring und es bestehen keine Interessenkonflikte. (red)