In der Ausgabe 7/8 2024 des Hessischen Ärzteblatts wurden die Amyloid-basierte Therapie und ihre Erfolge bei der Behandlung der Alzheimer Erkrankung durch Herrn Kollegen Johannes Pantel ausführlich erörtert [1]. Im vorliegenden Artikel werden diese „Erfolge“ einer kritischen Analyse unterzogen, zumal die Europäische Arzneimittelagentur (EMA) inzwischen beschlossen hat, diese Therapien in Europa nicht zuzulassen [2].
Unterscheidung zwischen familiärer und sporadischer Form der Alzheimer Erkrankung
Bei der Alzheimer Erkrankung ist eine vererbbare, familäre Form von der sporadischen Form, dem sog. Alters-Alzheimer zu unterscheiden. Die vererbbare Variante ist selten (weniger als 3 % der Fälle) und manifestiert sich bei meist jüngeren Menschen (ab 35 Jahren). Die veränderten Gene kodieren das Amyloid Precursor Protein (APP), Presenilin [3] und APOE4 [4]. Die meisten Patienten (ca. 90 %) erkranken jedoch an der sporadischen Form der Alzheimer Erkrankung. Die wichtigsten Risikofaktoren für diese Form sind das Alter und vermutlich auch Umwelteinflüsse, die allerdings noch nicht genau definiert sind.
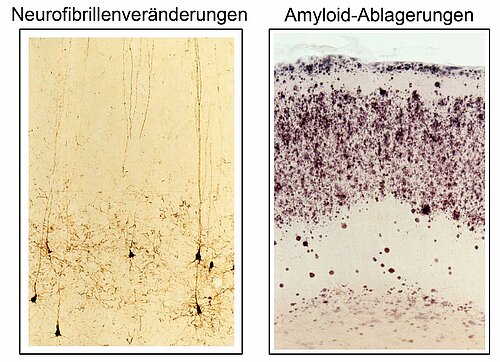
Charakteristische Veränderungen im Gehirn
Seit der Erstbeschreibung der Erkrankung durch Alois Alzheimer im Jahre 1906 [5] gelten zwei in der Endhirnrinde nachweisbare Veränderungen als charakteristische Krankheitsmerkmale: die innerhalb der Nervenzellen, also intrazellulär nachweisbaren Neurofibrillen-Veränderungen und die extrazellulär lokalisierten Amyloid-Ablagerungen (senilen Plaques), Abb. 1.
Die „Amyloid-Kaskaden- Hypothese“ und ihre Bedeutung für die Medikamentenentwicklung
Seit den 1990er-Jahren hat sich eine „Amyloid-Euphorie“ entwickelt und die Amyloid-beta-Ablagerungen werden seither von einer dominanten Gruppe von Alzheimer-Forschern auch bei der sporadischen Form als Hauptauslöser der Erkrankung angesehen. Die 1992 aufgestellte „Amyloid-Kaskaden-Hypothese“ [6] geht davon aus, dass Amyloid-beta der initiale Trigger der Neurodegeneration ist. Der lineare und leicht nachvollziehbare Ansatz der Kaskade wurde extrem populär, auch wenn sich früh abzeichnete, dass diese reduktionistische Sicht das Krankheitsgeschehen nicht adäquat abbildet. Die Alzheimer-Amyloid-Community war sehr aktiv in diesen Jahren, und es war schwer, alternative Ideen einzubringen oder die dominierende These gar anzuzweifeln [7]. Ausgehend von der „Amyloid-Kaskaden-Hypothese“ wurden monoklonale Antikörper entwickelt und in translatorischen, präklinischen und klinischen Untersuchungen getestet (Aducanumab [8], Lecanemab [9], Donanemab [10]). Ihr Einsatz wurde als Beginn einer neuen Ära in der pharmakologischen Demenzbehandlung gefeiert. Die Applikation der Antikörper führte zwar zu einer Reduktion der Amyloid-beta-Ablagerungen, aber nicht zu einer überzeugenden Steigerung der kognitiven Leistungen der Betroffenen. Auch sind die Therapien mit zum Teil erheblichen Nebenwirkungen behaftet [11]. Weiterhin ist interessant, dass mindestens 30 % der älteren Menschen Amyloid-beta-Protein-Ablagerungen im Gehirn aufweisen, ohne unter auffälligen kognitiven Einschränkungen zu leiden. Alle diese Befunde lassen die Rolle des Amyloid-beta als initialen Krankheitsauslöser stark anzweifeln und es erscheint daher nachvollziehbar, dass die EMA die auf Amyloid-zielende Therapie mit monoklonalen Antikörpern nicht zugelassen hat. Ob diese Entscheidung einen „Rückschlag für Europa“ bedeutet [2] oder sie die Erforschung und Entwicklung alternativer zielführenderer Therapieoptionen beflügelt, wird die Zukunft weisen.
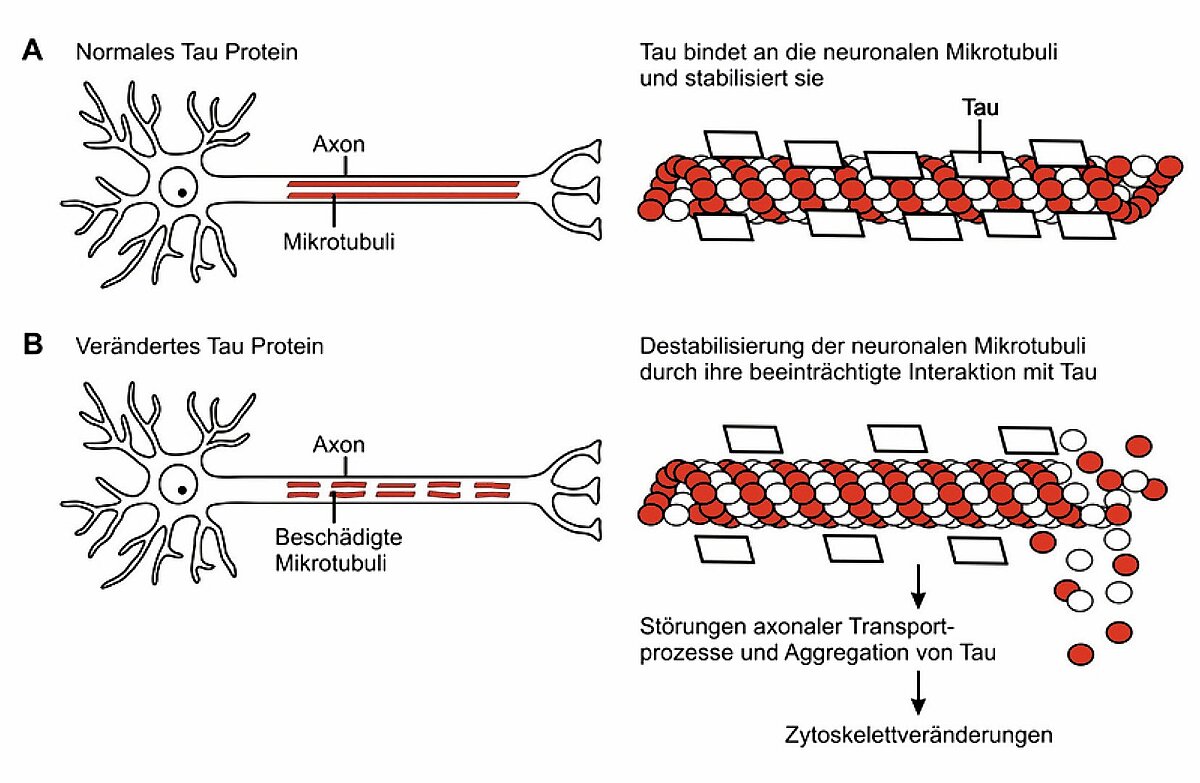
Neurofibrillen-Veränderungen
Hierbei handelt es sich um in den Nervenzellen lokalisierte Proteinablagerungen, die sich mit Versilberungstechniken (Gallyas-Versilberungen) und immunzytochemischen Methoden im Gehirn von Patienten sichtbar machen lassen. Heute wissen wir, dass die Veränderungen auf ein abnormal phoshoryliertes Tau-Protein zurückzuführen sind. Normales Tau interagiert mit neuronalen Mikrotubuli, die eine entscheidende Rolle beim axonalen Transport spielen (Abb. 2). Durch die abnormale Phoshorylierung des Tau-Proteins kommt es zu einer Destabilisierung der neuronalen Mikrotubuli, einer Störung des axonalen Transports und einer Aggregation von Tau-Protein, die sich als neuronale Fibrillen, neuronal tangles und Neuropilfäden manifestieren.
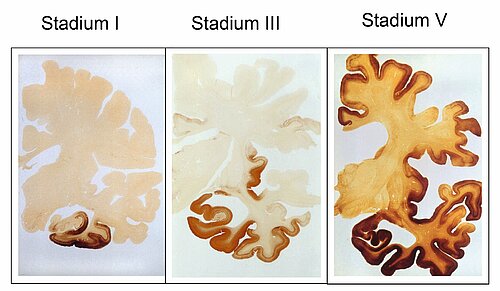
Mit ihren systematischen Studien zur Tau-Pathologie konnten Heiko und Eva Braak an der Dr. Senckenbergischen Anatomie in Frankfurt bahnbrechende Erkenntnisse gewinnen und legten 1991 auf Grund der Verteilung der pathologischen Tau-Aggregate in der Rinde des Endhirn (Telencephalon) eine Stadieneinteilung der Erkrankung vor (Braak-Stadien I-VI) [12, 13] (Abb. 3, nur online), die von der Weltgesundheitsorganisation (WHO) übernommen wurde.
Die Untersuchungen erbrachten die folgenden relevanten Ergebnisse: Die Neurofibrillenveränderungen sind bereits bei jüngeren Menschen nachweisbar [12–14], die keine klinischen Symptome zeigen und nehmen mit zunehmendem Alter kontinuierlich zu. Die Veränderungen sind nicht zufällig verteilt, sondern sie folgen einem stereotypen Muster, dass den neuronalen Verbindungen zwischen den betroffenen Hirngebieten folgt. Man kann daher die Alzheimer Erkrankung auch als „Konnektivitätspathologie“ [15] einordnen. Heiko Braak hat auf Grund dieser Befunde spekuliert, dass ein prionenähnlicher Mechanismus an der Ausbreitung der Neurofibrillenpathologie beteiligt ist, der durch „sekundäre“, noch nicht bekannte Auslöser getriggert wird [14].
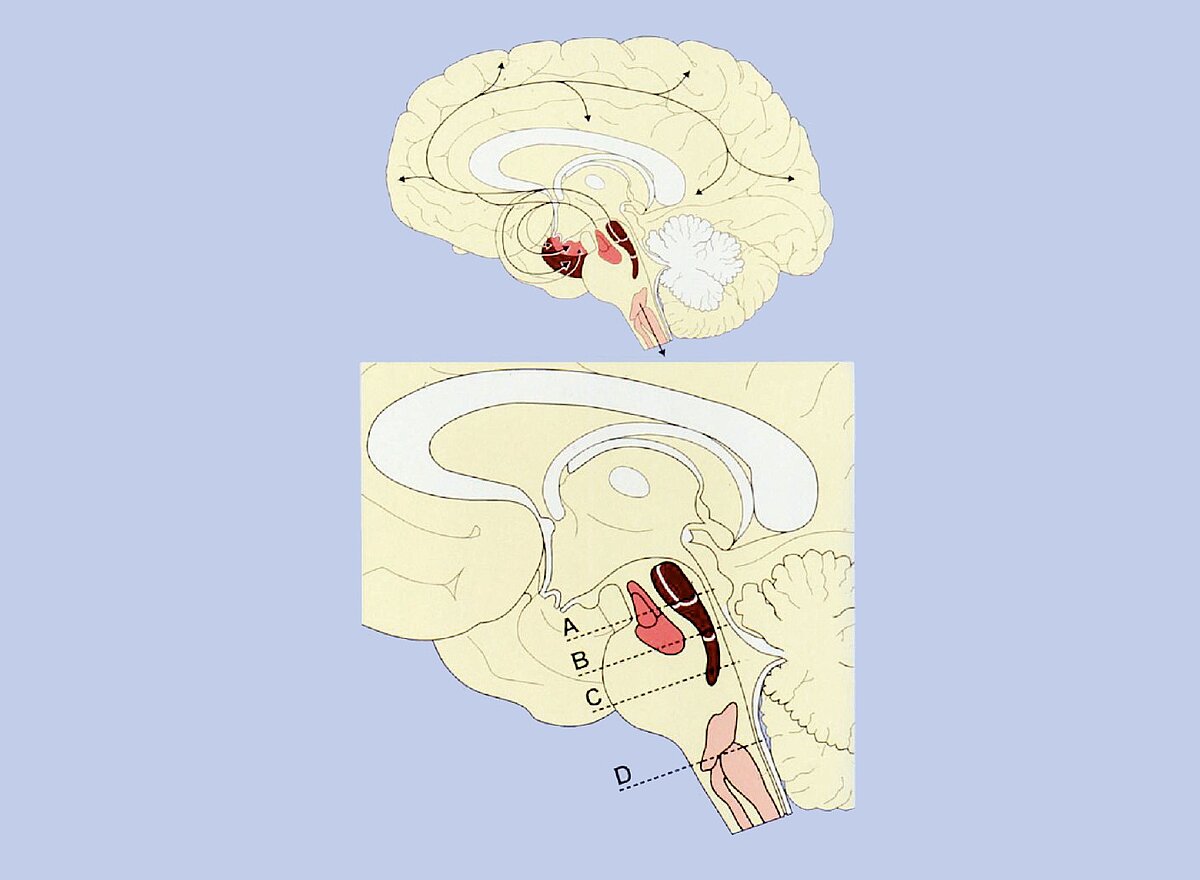
Die neuropathologischen Befunde stehen im Einklang mit klinischen Beobachtungen und weisen darauf hin, dass die Erkrankung schleichend einsetzt und dann über Jahre und Jahrzehnte hinweg kontinuierlich voranschreitet und die Symptome entsprechend immer ausgeprägter werden. Anders als bei der Parkinsonschen Erkrankung, bei der Ablagerungen auch im peripheren Nervensystem nachweisbar sind [16], sind die Neurofibrillenveränderungen bei der Alzheimerschen Erkrankung auf das Zentralnervensystem beschränkt. Neurofibrillenveränderungen finden sich jedoch nicht nur in der Endhirnrinde, sondern auch in Kerngebieten des Hirnstamms, die in das Telencaphalon projizieren (z. B. die serotoninhaltigen Raphe-Kerne und der noradrenerge Locus coeruleus) [17], Abb. 4 (nur online). Die Veränderungen im Hirnstamm manifestieren sich früher als die Veränderungen in der Endhirnrinde, so dass hier der „Port of Entry“ für die sekundären Prozesse sein könnte, die den Krankheitsprozess weiter triggern.
Ein entscheidender Befund für das Verständnis und die Einordnung der Mechanismen, die zur Entstehung und Entwicklung der Alzheimer Erkrankung beitragen, ist, dass sich die Neurofibrillenveränderungen wesentlich früher manifestieren als die Amyloidablagerungen [14] (Abb. 5). Bereits aus dieser zeitlichen Diskrepanz lässt sich folgern, dass die Amyloidablagerungen nicht als Trigger für die Entstehung der Krankheit verantwortlich sein können, sondern in ihrer Folge auftreten. Auch korrelieren die Neurofibrillenveränderungen wesentlich besser mit der Verminderung kognitiver Leistungen als die Amyloidablagerungen [18].
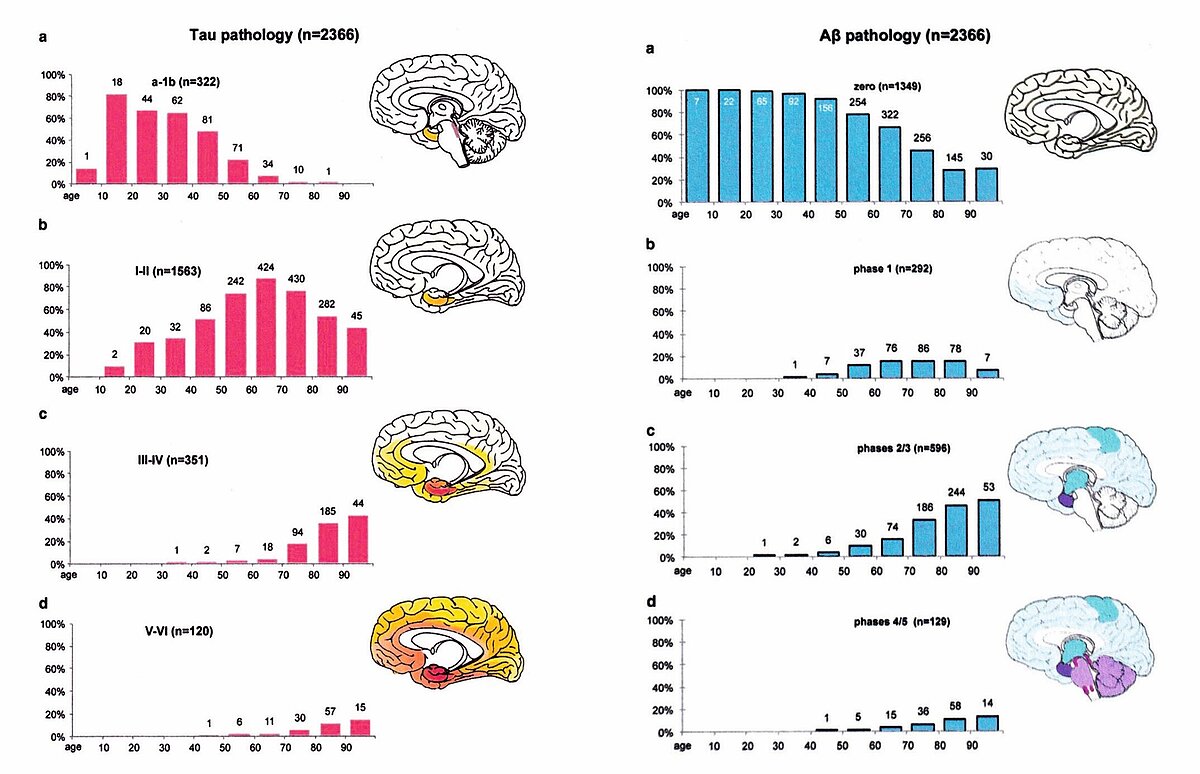
Insofern könnte ein vielversprechender therapeutischer Ansatz darin bestehen, die Entstehung der Neurofibrillenablagerungen zu verhindern oder zumindest zu verlangsamen. Die Umsetzung eines solchen Ansatzes dürfte jedoch nicht leicht sein, da es sich primär um intrazelluläre Veränderungen handelt und die entsprechenden Wirkstoffe in die Nervenzellen gelangen müssen. Proteomics-Analysen zeigen eine Interaktion zwischen hyperphosphorylierten Tau und proteosomalen sowie lysosomalen Abbauprozessen [19], die daher therapeutische Ziele sein könnten.
Auch anti-neuroinflammatorische Therapien, welche die Aktivität von Mikroglia und Astrozyten beeinflussen, sollten weiter erforscht werden [20, 21].
Fazit
Zusammenfassend lässt sich also festhalten: die abnormale Phosphorylierung des Tau-Proteins ist ein sehr frühes Ereignis in der Entwicklung des sporadischen Morbus Alzheimer und geht in späteren Stadien mit vielfältigen weiteren Veränderungen einher. Diese Prozesse nun als mögliche Therapieziele zu priorisieren, ist sowohl Herausforderung als auch Chance.
Prof. Dr. med. Horst-Werner Korf, ehem. Geschäftsführender Direktor der Dr. Senckenbergischen Anatomie Universität Frankfurt; ehem. Direktor des Dr. Senckenbergischen Chronomedizinischen Instituts; aktuell Institut für Anatomie I, Medizinische Fakultät, Heinrich Heine Universität Düsseldorf, E-Mail: korf@uni-duesseldorf.de
Die Literaturangaben und Angaben zu etwaigen Interessenkonflikten finden Sie hier.