Der Artikel ist ein genehmigter, gekürzter Nachdruck aus Arzneiverordnung in der Praxis (AVP) vorab online 9. Oktober 2020 (Ausgabe 3/2020), abrufbar unter www.akdae.de
Rote-Hand- und Informationsbriefe sollen Ärzte und Apotheker und ggf. andere Fachkreise schnell über Arzneimittelrisiken und deren Minimierung informieren.
Warum werden Rote-Hand-Briefe und Informationsbriefe versendet?
Zum Zeitpunkt der Zulassung ist das Sicherheitsprofil von Arzneimitteln noch nicht vollständig bekannt. Nach der Zulassung und Markteinführung werden sie von vielen Patienten angewendet, wodurch neue Sicherheitsaspekte bekannt werden, wie Nebenwirkungen, Wechselwirkungen, Kontraindikationen, Fehlgebrauch, Anwendung bei kritischen Patientengruppen und andere Arzneimittelrisiken. Einige der so gewonnenen neuen Erkenntnisse erfordern ein unmittelbares Handeln für den Arzt und/oder Apotheker und müssen ihnen schnellstmöglich mitgeteilt werden. Da die Aufnahme in die Fach- und Gebrauchsinformation des Arzneimittels eine gewisse Zeit in Anspruch nimmt und entsprechende Änderungen erst mit einer Zeitverzögerung zur Kenntnis genommen werden, kann es daher erforderlich sein, diese wichtigen Informationen schnell den Fachkreisen mittels Rote-Hand-Brief mitzuteilen. Solche Risikoinformationen können z. B. eine neue Kontraindikation oder neue Warnhinweise sein. Auch ein Rückruf aufgrund eines erheblichen Qualitätsmangels eines Präparates kann mittels Rote-Hand-Brief kommuniziert werden. Pharmazeutische Unternehmer (pU) müssen geplante Risikoinformationen zu Arzneimitteln wie Rote-Hand-Briefe mit den zuständigen nationalen Behörden im Hinblick auf Inhalt und Adressatenkreis abstimmen.
Was ist der Unterschied zwischen einem Rote-Hand-Brief und einem Informationsbrief?
Ein Rote-Hand-Brief soll die Fachkreise rasch über neue therapierelevante Aspekte informieren, die noch nicht in der Fachinformation enthalten sind. Rote-Hand-Briefe werden auch zur Erinnerung an die Einhaltung wichtiger bestehender Kontraindikationen und Warnhinweise verwendet, wenn z. B. Erkenntnisse vorliegen, dass solche Vorgaben bei der Verordnung nicht genügend Beachtung finden. Dagegen informiert ein Informationsbrief die Fachkreise beispielsweise über eine Erweiterung der Zulassung (z. B. Anwendungserweiterung) oder über bestimmte qualitative Aspekte (z. B. geänderte farbliche Markierung auf der Primärverpackung zur Vermeidung von Verwechslung). Informationsbriefe enthalten hilfreiche Informationen für die Fachkreise. Da sie grundsätzlich keine Handlungsanweisungen enthalten und nicht über neue Arzneimittelrisiken informieren, werden sie nicht mit dem Symbol der Roten Hand gekennzeichnet. Die Informationsbriefe werden in der Regel auch mit der zuständigen Bundesoberbehörde (BfArM oder PEI) oder mit der zuständigen Landesbehörde abgestimmt. In Tab. 1 sind Beispiele von Rote-Hand- und Informationsbriefen zum direkten Vergleich dargestellt.
Wer bekommt die Rote-Hand-Briefe und Informationsbriefe?
Der überwiegende Teil der Rote-Hand- und Informationsbriefe resultiert aus europäischen Risikobewertungs- oder Signalverfahren, in denen Risiken evaluiert und Maßnahmen zu deren Minimierung beschlossen werden. Zielgruppen können Ärzte der verschiedensten Fachrichtungen sein, Apotheker, aber auch Fachgesellschaften, Pflegepersonal etc. Die Arzneimittelkommission der Deutschen Apotheker (AMK) und die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) werden in Deutschland routinemäßig informiert. Die Versendung eines Rote-Hand-Briefes kann aber auch rein national durch die zuständige Bundesoberbehörde angeordnet werden:
- Paul-Ehrlich-Institut (PEI): für Sera, Impfstoffe, Blutzubereitungen, Gewebezubereitungen, Gewebe, Allergene, Arzneimittel für neuartige Therapien (ATMP), xenogene Arzneimittel und gentechnisch hergestellte Blutbestandteile (www.pei.de).
- Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM): für alle anderen humanen Arzneimittel bzw. für alle Medizinprodukte (www.bfarm.de).
Wer versendet die Rote-Hand-Briefe und Informationsbriefe?
Rote-Hand-Briefe und Informationsbriefe werden durch die pharmazeutischen Unternehmer eigenverantwortlich als risikominimierende Maßnahme versendet. Sie sind definiert in § 14 der Kodizes der Vereine „Freiwillige Selbstkontrolle für die Arzneimittelindustrie e. V.“ (FSA) und „Arzneimittel und Kooperation im Gesundheitswesen e. V.“ (AKG). Die Bildmarke des Symbols der Roten Hand wurde rechtlich geschützt. Der Inhalt und der Empfängerkreis werden je nach Zuständigkeit bei Humanarzneimitteln mit dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder dem Paul-Ehrlich-Institut (PEI) oder bei Qualitätsmängeln mit der zuständigen Landesbehörde abgestimmt. Die pharmazeutischen Unternehmer beauftragen nach Freigabe durch die Behörde die entsprechenden Druckereien und Distributoren mit dem Versand, der zurzeit ausschließlich per Post erfolgt.
Verbindliche Informationen
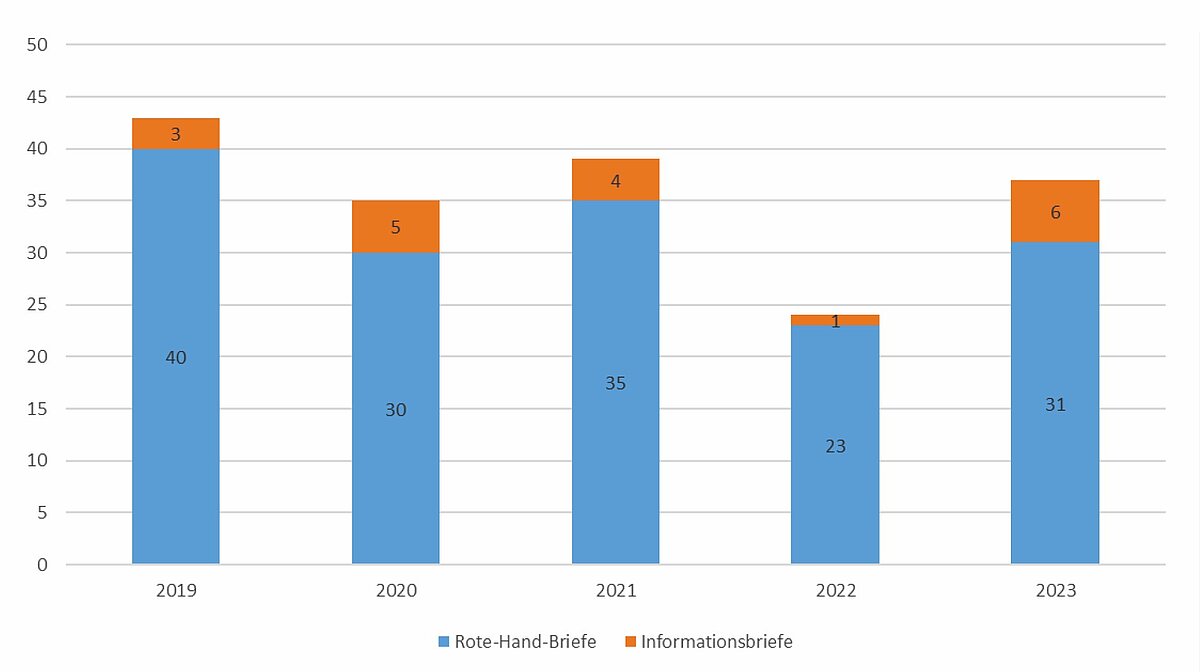
Die im Rote-Hand-Brief enthaltenen Informationen stellen jeweils den neuesten wissenschaftlichen Kenntnisstand dar, über den die Fachkreise informiert sein müssen. Die Informationen finden entsprechend auch Eingang in die Fach- und Gebrauchsinformation der betroffenen Arzneimittel und sind in der ärztlichen Praxis daher sorgfältig zu berücksichtigen (vgl. Abb. 1).
Persönliche Zustellung
Nicht jeder Arzt bekommt jeden Rote-Hand-Brief und Informationsbrief persönlich per Post. Dies richtet sich u. a. nach der Fachrichtung und Anwendung des Arzneimittels. Wenn sich z. B. ein Rote-Hand-Brief auf ein Risiko bezieht, das ein Arzneimittel mit gynäkologischer Indikation betrifft, wird dieser hauptsächlich an Fachärzte für Gynäkologie und Geburtshilfe (sowohl niedergelassene als auch in der Klinik praktizierende Ärzte) versendet, ggf. auch an Hebammen und Geburtshelfer sowie an Ärzte anderer Fachrichtungen, sofern davon auszugehen ist, dass diese die betroffenen Arzneimittel ebenfalls anwenden bzw. verordnen könnten. In diesem Beispiel würden Fachärzte für z. B. Augenheilkunde oder Orthopädie nicht zum Adressatenkreis gehören.
Elektronische Version
In Deutschland wird der Rote-Hand-Brief derzeit postalisch an die definierten Zielgruppen (Ärzte, Apotheker, medizinische Fachkreise) verschickt und auf den jeweiligen Websites der Zulassungsinhaber, der Bundesoberbehörden BfArM und PEI sowie der Arzneimittelkommissionen veröffentlicht. Durch diese Zustellung soll sichergestellt werden, dass der Empfänger bestmöglich erreicht wird. Derzeit wird diskutiert, ob eine direkte elektronische Zustellung zeitgemäßer, kostengünstiger und vor allem schneller ist.
Links im Internet
Alle Rote-Hand-Briefe und Informationsbriefe sind elektronisch verfügbar. Sie sind auf der Webseite der AkdÄ veröffentlicht: https://www.akdae.de/arzneimittelsicherheit/rote-hand-briefe/. Eine elektronische Benachrichtigung durch die AkdÄ ist über ein kostenloses Abonnement des Newsletters „Drug Safety Mail“ möglich.
Alle Rote-Hand-Briefe und Informationsbriefe zu Arzneimitteln in der BfArM-Zuständigkeit sowie Qualitätsmängel betreffend (Zuständigkeit Landesbehörden) sind auf der BfArM-Homepage abrufbar unter: https://www.bfarm.de/
→ Arzneimittel/Pharmakovigilanz/Risikoinformationen/Rote-Hand-Briefe/
Dort besteht auch die Möglichkeit, einen RSS-Feed, den Newsletter oder auch das Bulletin zur Arzneimittelsicherheit zu abonnieren. Alle Rote-Hand-Briefe zu Arzneimitteln in der Zuständigkeit des Paul-Ehrlich- Instituts (PEI) sind verfügbar unter: https://www.pei.de → arzneimittelsicherheit/pharmakovigilanz (human)
Genoveva Dimitrova, E-Mail: genoveva.dimitrova@bfarm.de
Die Literaturhinweise finden Sie hier.
| Tabelle 1: Beispiele für Rote-Hand- und Informationsbriefe [3] | |
| Rote-Hand-Brief | Informationsbrief |
| Rote-Hand-Brief zu kombinierten hormonalen Kontrazeptiva – Chlormadinonacetat/Ethinylestradiol: Leicht erhöhtes Risiko für venöse Thromboembolien (23.02.2024) | Informationsbrief zu Actilyse® Pulver und Lösungsmittel zur Herstellung einer Injektions- bzw. Infusionslösung (Alteplase) bei akutem ischämischen Schlaganfall: Wichtige Anwendungserweiterung bei Jugendlichen ≥ 16 Jahren (22.06.2018) |
| Rote-Hand-Brief zu Valproat: Mögliches Risiko für neurologische Entwicklungsstörungen bei Kindern, deren Väter mit Valproat behandelt wurden (19.02.2024) | Informationsbrief zu Mitomycin: Aufhebung der Anwendungseinschränkungen von Mitomycin-Präparaten bei intravenöser Gabe (10.08.2023) |
| Rote-Hand-Brief zu Pseudoephedrin: Risiko für posteriores reversibles Enzephalopathiesyndrom und reversibles zerebrales Vasokonstriktionssyndrom (15.02.2024) | Informationsbrief zu Spiolto® Respimat®: möglicherweise defekter Dosiszähler bei den Chargen E44551A und E56624 (01.03.2024) |