Prof. Dr. oec. troph. Dr. med. Jürgen Stein, PD Dr. med. Michael Schumann
Ein Abkürzungsverzeichnis finden Sie am Ende dieses Artikels.
Viele Menschen sind davon überzeugt, dass unverträgliche Nahrungsmittel die Ursache ihrer Beschwerden sind. Weizen und Gluten werden von vielen als Hauptschuldige ausgemacht. Weizenwampe – warum Weizen dick und krank macht oder Weizen, das „Killerkorn“, machen nicht nur in den USA Schlagzeilen. Die Zahl der Menschen, die sich glutenfrei ernähren, hat sich in den USA in den vergangenen Jahren mehr als verdreifacht [1]. Laut einer im Handelsblatt zitierten Umfrage in Deutschland aus dem Jahr 2015 meiden 9 % der Verbraucher glutenhaltige Lebensmittel. Etwa 5 % der deutschen Bevölkerung ernähren sich sogar glutenfrei. Nur ein kleiner Teil dieser Patienten leidet an der leicht zu diagnostizierenden Zöliakie. Vor allem junge Frauen zwischen 20 und 39 Jahren ernähren sich der Studie zufolge bewusst glutenfrei [2, 3].
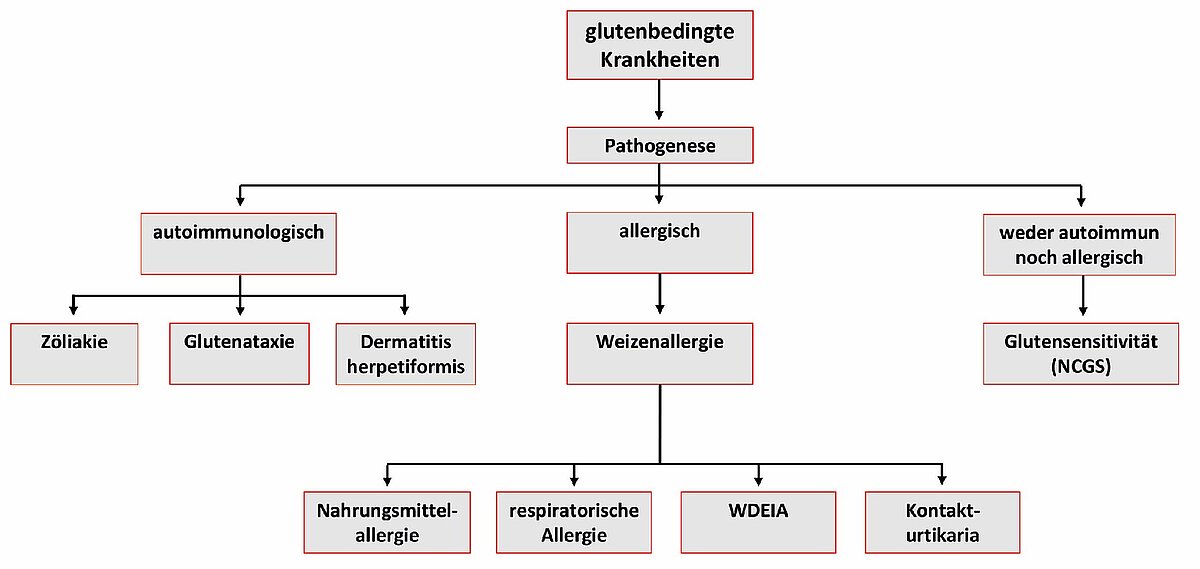
Der Einfluss des Weizens, genauer des Glutens, auf die Zöliakie ist unbestritten. Zöliakie ist eine chronische Erkrankung des Dünndarms, die auf einer lebenslangen Unverträglichkeit von Gluten beruht. Gluten ist in allen Weizensorten enthalten. Das zweite klar definierte und diagnostizierbare Krankheitsbild ist die Weizenallergie. In jüngerer Zeit häufen sich die Hinweise auf ein neues Krankheitsbild, die sogenannte Nicht-Zöliakie-Weizensensitivität (NCWS), deren klinische Symptomatik sich teilweise mit dem Reizdarmsyndrom überschneidet (Abb. 1).
Der nachfolgende Beitrag orientiert sich im Wesentlichen an den zentralen Inhalten der aktualisierten S2k-Leitlinie Zöliakie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) [4].
Zöliakie
Die Zöliakie ist eine lebenslange, multisystemische, immunologisch vermittelte Darmerkrankung, die sich – ausgelöst durch Gluten und verwandte Prolamine – bei genetisch prädisponierten Personen manifestiert und zu charakteristischen histomorphologischen Veränderungen der proximalen Dünndarmschleimhaut (entzündliche Infiltrate, Kryptenhyperplasie, Villusatrophie) sowie potenziellen systemischen Komplikationen führt [4].
Die Prävalenz der Zöliakie liegt weltweit (in Amerika und Europa sowie in Australien, Nordafrika, dem Nahen Osten und Indien) bei 0,5–1 %. Deutlich häufiger ist die Erkrankung jedoch in der Bevölkerung Finnlands und Mexikos sowie bei den Sahrawi-Kindern Nordafrikas. Hier liegen die Prävalenzen zwischen 2 und 5 % [5–8]. Basierend auf einem rein serologischen Screening wird auch für Deutschland eine Prävalenz von knapp 1 % berichtet. Grundsätzlich kann die Zöliakie in jedem Lebensalter auftreten. Am häufigsten erkranken Menschen im Alter zwischen ein und acht Jahren bzw. zwischen 20 und 50 Jahren [4]. Frauen sind 1,5- bis zweimal häufiger betroffen als Männer. Die Prävalenz für eine Zöliakie ist bei Angehörigen 1. Grades (10–15 %) sowie bei Patienten mit anderen Autoimmunerkrankungen, wie z. B. Typ-1-Diabetes (3–16 %), Hashimoto-Thyreoiditis (5 %) oder IgA-Mangel (3–9 %), deutlich erhöht [4].
Eine definierte genetische Prädisposition für Zöliakie wurde in epidemiologischen Studien an Zöliakiepatienten nachgewiesen, in denen gezeigt werden konnte, dass 7,5 % der Verwandten ersten Grades eines Zöliakiepatienten ebenfalls erkrankt sind. Sind zwei oder mehr Verwandte ersten Grades betroffen, steigt das Risiko auf 17 %. Bei eineiigen Zwillingen lassen sich Konkordanzraten von über 75 % nachweisen [4].
Als mit Abstand wichtigste Risikofaktoren wurden die (HLA) Klasse II-Gene HLA-DQ2 und -DQ8 identifiziert: 90–95 % aller europäischen Zöliakiepatienten sind HLA-DQ2 positiv, 5–10 % DQ8 positiv [4].
Aber! Auch 30–35 % der kaukasischen Bevölkerung sind HLA-DQ2 und/oder DQ8 positiv, aber nur 2–4 % erkranken an Zöliakie, was auf Umweltfaktoren hinweist, da der Beitrag anderer genetischer Prädispositionen eher gering ist. In genomweiten Assoziationsstudien (GWAS) wurden bisher mehr als 100 Genloci beschrieben, die Zöliakie-assoziierte genetische Polymorphismen beherbergen, von denen 39 vermutlich immunologisch relevant sind. Sie machen jedoch wahrscheinlich nicht mehr als 8 % des gesamten genetischen Risikos aus [4].
Was ist eigentlich Gluten?
Häufig wird Gluten mit Weizen gleichgesetzt, was jedoch nicht korrekt ist. Gluten fasst die Gliadine und Glutenine des Weizens in einem Begriff zusammen. Glutene – Speicherproteine in den Getreidearten Weizen (einschließlich Einkorn, Emmer, Dinkel und Grünkern), Roggen und Gerste – sind aufgrund ihrer Klebereigenschaften (lat.: „gluten“, Kleber) wesentlich für die Backfähigkeit von Getreidemehl. Sie sind die zentralen auslösenden Umweltfaktoren der Zöliakie.
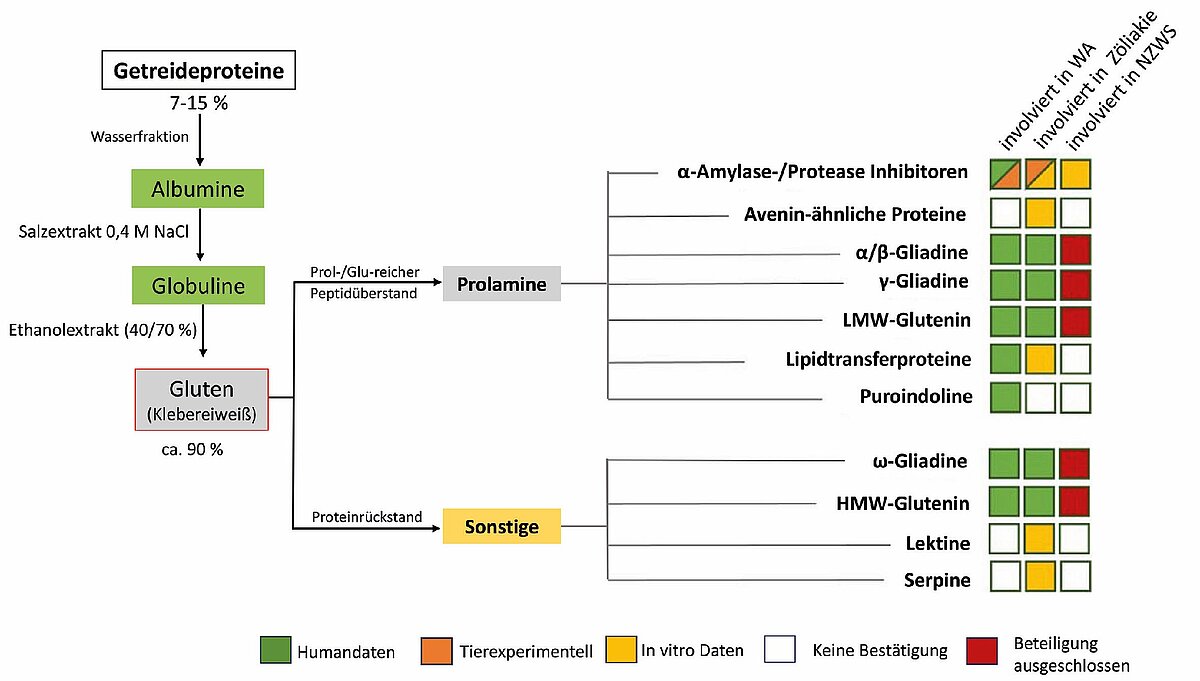
Kleberproteine zeichnen sich einerseits durch einen hohen Gehalt an den Aminosäuren Glutamin und Prolin und andererseits durch einen niedrigen Gehalt an aromatischen und anderen essenziellen Aminosäuren aus. Nach sequenzieller Extraktion mit Wasser, Kochsalzlösung und 60%igem Ethanol wurde von Osborne und Clapp 1907 [9] eine Unterteilung in Albumine, Globuline und Prolamine sowie die im Rückstand verbleibenden unlöslichen Glutenine vorgenommen. Albumine und Globuline befinden sich hauptsächlich in der äußeren Schicht des Getreidekorns, Gluten und Glutenine im Mehlkörper. Die alkohollöslichen Prolamine bestehen überwiegend aus monomeren Proteinen, die entweder cysteinfrei sind (ω-Gliadine) oder nur ketteninterne Disulfidbrücken aufweisen (α- und γ-Gliadine). Gluten besteht hauptsächlich aus α-Gliadinen mit geringeren Anteilen an γ-Gliadinen und ω-Gliadinen, die sich durch den höchsten Gehalt an Glutamin, Prolin und Phenylalanin auszeichnen und im modernen (hexaploiden) Weizen 5–8 % der Prolamine ausmachen [10] (Abb. 2).
Anmerkung: Der wissenschaftliche Name Gliadin bezieht sich streng genommen nur auf die Speicherproteine des Weizens, während die wichtigsten Verwandten und potenziell Zöliakie auslösenden Proteine in Roggen und Gerste als Roggensekalin bzw. Gerstenhordein bezeichnet werden. Während Weizen, Roggen und Gerste einen gemeinsamen Ursprung in der Familie der Gräser haben, ist Hafer genetisch weiter entfernt und gilt in reiner Form als harmlos für Zöliakie-Patienten [4].
Die Pathogenese der Zöliakie ist multifaktoriell, wobei Umweltfaktoren (Gluten), immunologische Faktoren sowie eine genetische Prädisposition von Bedeutung sind (Abb. 3). Eine zentrale Rolle in der Pathogenese der Zöliakie spielt der außergewöhnlich hohe Gehalt an Prolin und Glutamin (→ Prolamine) in den Gliadinen des Weizens sowie in den Hordeinen und Secalinen, teilweise auch in den Gluteninen. Dies resultiert in einer Hemmung (Resistenz) der enzymatischen Aktivität von Pepsin, Trypsin, Chymotrypsin und mukosalen Prolylendopeptidasen, was letztlich zur Akkumulation relativ großer Mengen immunogener Glutenpeptide führt.
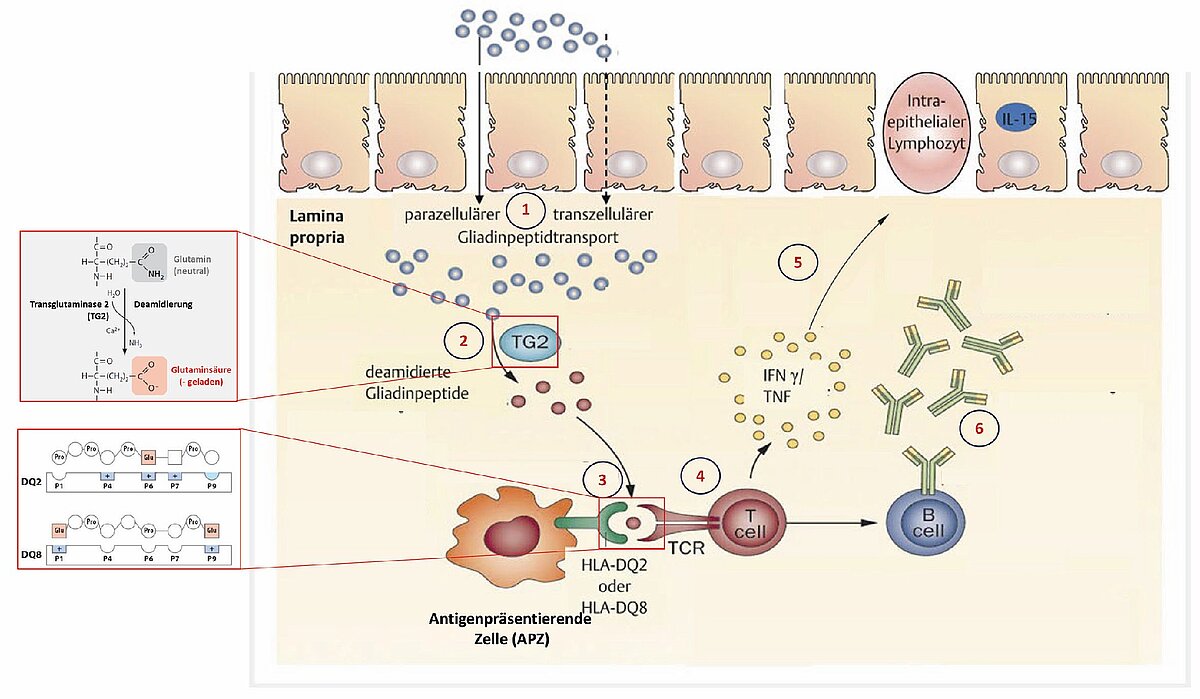
Nach überwiegend transzellulärer Überwindung der epithelialen Barriere werden die Glutenpeptidreste durch die Gewebstransglutaminase (TG2) deamidiert, woraus eine bessere Bindung an HLA-DQ2 bzw. HLA-DQ8 auf antigenpräsentierenden Zellen (APC) resultiert und die Entzündungsreaktion potenziert wird [11, 12].
Somit spielen die Transglutaminase 2 (TG2) als Autoantigen sowie die HLA Klasse II-Gene HLA-DQ2 und -DQ8 eine Schlüsselrolle in der Pathogenese der Zöliakie, da nach Bindung der negativ geladenen Glutaminsäurereste, die von APC präsentierten Peptide glutenspezifische zytotoxische T-Zellen und T-Helfer-Zellen aktivieren und konsekutiv weiterhin T-Killer-Zellen aktiviert werden, wodurch zytotoxische T-Zellen, Makrophagen und Myofibroblasten durch Sekretion eines spezifischen Zytokinmusters den Matrix- und damit den Mukosaumbau induzieren. Andererseits gelangen die aktivierten Immunzellen in andere Bereiche des Körpers, wo sie extraintestinale Symptome auslösen können [11, 12].
Die klinischen Manifestationen der Zöliakie können sehr unterschiedlich sein und reichen von völliger Symptomfreiheit (asymptomatische Zöliakie) über ein breites Spektrum intestinaler Symptome wie Diarrhoe, Steatorrhoe und Malabsorption (klassische Zöliakie) bis hin zu atypischen Symptomen (z. B. neurologische Manifestationen wie Depression, Migräne oder zerebelläre Ataxie). Reproduktionsstörungen einschließlich Menarche und Klimakterium; und orale/kutane Erkrankungen wie Dermatitis herpetiformis oder Vitiligo (Tab. 1). Es gibt kein klinisches Bild (z. B. Adipositas, Obstipation etc.), das per se eine Zöliakie ausschließt [4].
Tab. 1: Formen der Zöliakie entsprechend der Oslo-Klassifikation [nach 40] | ||||
Form der Zöliakie | Klinik | Serologie, d. h. zöliakiespezifische Antikörper (Anti-EmA, anti-TGA) | Genetik HLA- | Histologie |
Klassisch | Zeichen der Malabsorption | + | DQ2 / DQ8 | Marsh 2 oder 3 |
Symptomatisch | Unspezifische gastrointestinale oder extraintestinale Symptome | + | DQ2 / DQ8 | Marsh 2 oder 3 |
Subklinisch | Ohne klinische Symptome, aber auffällige Laborwerte oder klinische Verbesserung unter Diät | + | DQ2 / DQ8 | Marsh 2 oder 3 |
Potenziell | Keine oder wenig spezifische Symptome oder Zeichen | + | DQ2 / DQ8 | Marsh 0 oder 1 |
Refraktär (bislang nur bei Erwachsenen beschrieben) | Zeichen der Malabsorption und Zottenatrophie trotz glutenfreier Diät über 12 Monate | Bei Erstdiagnose positiv, im Verlauf negativ oder positiv | DQ2 / DQ8 | Marsh 3 |
Eine refraktäre Zöliakie (RZ) liegt vor, wenn trotz konsequenter Einhaltung einer glutenfreien Diät (GFD) über zwölf Monate intestinale morphologische Veränderungen und intestinale oder extraintestinale Symptome persistieren oder wieder auftreten [4]. Das mittlere Erkrankungsalter liegt bei ca. 50 Jahren, Frauen sind deutlich häufiger betroffen als Männer. Die Einteilung der RZ in Typ I (RZ I) und Typ II (RZ II) erfolgt anhand der Charakterisierung der infiltrierenden T-Zellen: Während beim Typ I keine prominente T-Zellklonalität vorliegt und die CD3/CD8 T-Zelloberflächenantigene wie bei der normalen Zöliakie im Dünndarm exprimiert werden, findet sich beim Typ II neben einer prominenten T-Zellklonalität ein Verlust der CD3/CD8 Oberflächenantigene in mehr als 50 % der intraepithelialen Lymphozyten (IEL). Warum sich die Darmschleimhaut bei RZ I trotz GFD nicht erholt bzw. ein Rezidiv auftritt, ist unklar. IL-15 scheint dabei eine Rolle zu spielen (siehe unten). Die RZ II ist eine lebensbedrohliche Erkrankung mit einer 5-Jahres-Mortalitätsrate von bis zu 50 % [13, 14].
Diagnostik
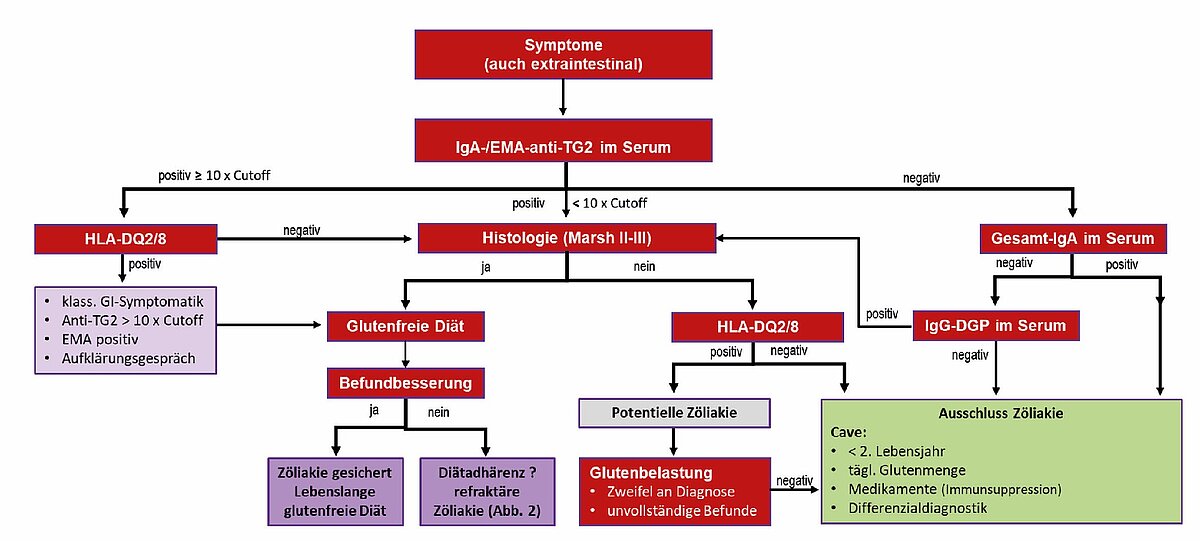
Für die Diagnose der Zöliakie gibt es keinen einzelnen beweisenden Test (Goldstandard). Grundlage der Diagnostik sind (Abb. 4) [4]:
- die serologische Bestimmung spezifischer Antikörper (IgA/EMA-Anti-TG2, Gesamt-IgA)
- die histologische Aufarbeitung von Biopsaten aus dem Zwölffingerdarm
- ggf. HLA-Typisierung (HLA-DQ2/8)
Hinweis: Bei Verdacht auf Zöliakie soll vor Einleitung einer Diagnostik (Serologie, Endoskopie) die Glutenzufuhr in der Ernährung der Patientinnen und Patienten anamnestisch erhoben und dokumentiert werden. Wurde bereits mit einer glutenfreien oder glutenreduzierten Ernährung begonnen, kann eine sichere Diagnose erst nach einer Glutenexposition (15 g Gluten (ca. sechs Scheiben Brot pro Tag) über acht bis zwölf Wochen) gestellt werden [4].
Die Diagnose einer Zöliakie gilt als gesichert [1] bei
- positiver Serologie
- positiver Histologie (das heißt Marsh-Klassifikation 2 oder 3)
- serologischer Besserung unter glutenfreier Diät
Aufgrund des bei Zöliakiepatienten ca. 10–20-fach erhöhten Risikos für einen selektiven IgA-Mangel muss dieser im Rahmen des serologischen Screenings regelmäßig ausgeschlossen werden.
Hinweis: Bei Kindern mit klinischen Symptomen und Zeichen einer Malabsorption kann die Diagnose einer Zöliakie auch ohne Dünndarmbiopsie gestellt werden, wenn:
- die TG2-IgA-Titer über dem zehnfachen des oberen Grenzwertes liegen,
- EmA-IgA aus einer zweiten, unabhängigen Blutprobe ebenfalls positiv ist,
- die genetische Untersuchung HLA-DQ2.5 oder -DQ8 ergibt und
- die Symptome unter einer glutenfreien Diät verschwinden.
Aufgrund der ausgeprägten genetischen Komponente sollte bei allen erstgradigen Verwandten und Geschwistern von Betroffenen eine Zöliakie ausgeschlossen werden. Dies gilt auch für Patienten mit Diabetes mellitus Typ I und einer Autoimmunerkrankung der Schilddrüse (Hashimoto-Thyreoditis [4].
Therapie
Seit der Beschreibung eines „Weizenfaktors“ vor nunmehr 60 Jahren durch den holländischen Kinderarzt Wilhelm Dicke [15] als Auslöser der Erkrankung, den der Chemiker van de Kamer später als Gluten identifizierte, gilt die lebenslange strikte glutenfreie Diät als therapeutischer Eckpfeiler [10]. Als glutenfrei gelten nach dem Codex alimentarius (http://www.wheat-free.org/celiac-disease-codex-alimentarius.html) Lebensmittel mit < 20 ppm Gluten (= Voraussetzung für die Kennzeichnung „glutenfrei“), das entspricht weniger als 10 mg Gluten pro Tag. Diese Menge gilt auch bei empfindlichen Patienten als unbedenklich [16–18]. Zum Vergleich: Mit der üblichen westlichen Ernährung werden täglich 15–20 g Gluten aufgenommen.
Neben den intestinalen Symptomen verbessert die GFD auch alle mit der Malabsorption assoziierten Erkrankungen (Tab. 2). Sie führt auch zur Abheilung einer Dermatitis herpetiformis und bei Patienten mit begleitendem Typ I-Diabetes häufig zu einer Verbesserung der Insulineinstellung [4].
Tab. 2: Übersicht über gastrointestinale und extraintestinale Symptome der Zöliakikie [51] | |
gastrointestinal | extraintestinal |
• chronische Diarrhö • chronische abdominelle Schmerzen • Malabsorption • Flatulenz • Symptome eines Colon irritabile • Obstipation • Gewichtsverlust, Anorexie • Übelkeit, Erbrechen • gastroösophagealer Reflux | • Eisenmangelanämie • Vitaminmangel (B12, B6, Folsäure, Zink) • Fatigue • rezidivierende Aphthen der Mundhöhle • Transaminasenerhöhung • Gedeihstörung, Entwicklungsverzögerung, verspätete Pubertät, Amenorrhö • frühe Menopause, Infertilität • Dermatitis herpetiformis • Osteopenie, Osteoporose • Hypoplasie des Zahnschmelzes • periphere Neuropathie • Hyposplenie |
Patientinnen und Patienten sollten nach gesicherter Diagnose einer Zöliakie zeitnah eine professionelle therapeutische Ernährungsberatung erhalten [1]. Um eine fehlerfreie und auch im Hinblick auf mögliche Folgeerkrankungen günstige Durchführung der Diät zu gewährleisten, ggf. zu optimieren und Diätfehlern vorzubeugen, sollte eine therapeutische Ernährungsberatung bei Bedarf ein- bis zweimal jährlich wiederholt werden [4].
Allerdings ist bei vielen Patienten im Verlauf der Erkrankung eine zunehmend schlechtere Compliance zur GFD zu beobachten, da Gluten in den meisten Fertignahrungsmitteln (oft nicht deklariert) enthalten ist und eine konsequente Meidung daher zu erheblichen Einschränkungen in der Lebensmittelauswahl, der geschmacklichen Qualität und zu erhöhten Lebenshaltungskosten führt. Die Einhaltung der GFD sollte insbesondere bei jugendlichen Zöliakiebetroffenen nach dem Übergang in das Erwachsenenalter überprüft und gegebenenfalls verbessert werden [4, 19, 20]. Betroffenen sollte nach der Diagnosestellung der Kontakt zu einer Selbsthilfegruppe vermittelt werden, da regelmäßige Gruppentreffen den Erfahrungsaustausch fördern und entscheidend zur Compliance und Lebensqualität beitragen [4].
Kontaktdaten:
- www.dzg-online.de (Deutsche Zöliakie-Gesellschaft e. V.)
- www.zoeliakie.or.at (Österreichische Arbeitsgemeinschaft Zöliakie)
- www.zoeliakie.ch (IG Zöliakie der Deutschen Schweiz)
IgE- und nicht-IgE-vermittelte Weizenallergien
In Weizen und seinen Urformen wie Dinkel, Einkorn und Emmer sind zahlreiche wasser-/salzlösliche und wasserunlösliche Proteine beschrieben, die allergisch relevant sein können. Während die wasser-/salzlöslichen Proteinmuster bei allen Weizensorten vergleichbar sind, unterscheiden sich die wasserunlöslichen Proteinfraktionen deutlich. Auch wenn von Betroffenen teilweise eine bessere Verträglichkeit berichtet wird, gibt es keine gute Evidenz für eine geringere Allergenität älterer Getreidesorten [21].
IgE-vermittelte Soforttypreaktionen nach Weizenverzehr
IgE-vermittelte Weizenallergien unterscheiden sich in ihrer Manifestation je nach Lebensalter: Während sie sich im Säuglings- und Kleinkindesalter meist mit klassischen allergischen Soforttyp-Reaktionen an Haut, Atemwegen, Gastrointestinaltrakt und Herz-Kreislaufsystem bzw. mit Spätreaktionen im Sinne einer Hautverschlechterung bei atopischer Dermatitis manifestieren, treten im Erwachsenenalter vor allem die Trigger-assoziierten Formen der anstrengungsinduzierten Weizenallergie auf. Glücklicherweise verschwinden die meisten dieser frühkindlichen Allergien bis zum Schulalter [21].
Co-Faktor-getriggerte Weizenallergie
IgE-vermittelte Weizenallergien sind im Erwachsenenalter eher selten. Sie treten vor allem in Kombination mit einem Auslöser auf, der die allergische Reaktion auf einen Gliadinbestandteil des Weizens erst auslöst oder eine bestehende hohe Schwellendosis deutlich absenkt. Da dieses Krankheitsbild erstmals mit körperlicher Anstrengung als Auslöser beschrieben wurde, hat sich der Begriff der weizenabhängigen, anstrengungsinduzierten Anaphylaxie (WDEIA, wheat dependent exercise-induced anaphylaxis) etabliert, obwohl inzwischen auch verschiedene andere Auslöser beschrieben wurden (Alkohol, nichtsteroidale Antiphlogistika) [22].
Die WDEIA führt nach dem Verzehr von Brot, Pizza oder Pasta in Kombination mit einem Cofaktor zu einer allergischen Soforttypreaktion. Bei ca. 80 % der Patienten können spezifische IgE-Antikörper gegen rekombinantes ω-5-Gliadin (Tri a 19) nachgewiesen werden. Die Notwendigkeit eines Verstärkungsfaktors erklärt, warum die einzelnen WDEIA-Attacken meist sporadisch und mit zeitlicher Verzögerung (innerhalb von 1–6 Stunden nach Nahrungsaufnahme) auftreten [21, 22].
Nicht-IgE-vermittelte Weizenallergien
Nicht-IgE-vermittelte allergische Reaktionen auf Weizen sind als Auslöser der eosinophilen Ösophagitis und der eosinophilen Gastroenteritis beschrieben [4]. Dazu gehört auch das Food-Protein Induced Enterocolitis Syndrom (FPIES), bei dem ausgeprägte gastrointestinale Symptome zeitverzögert (meist 1–4 Stunden) nach Allergenexposition auftreten können. FPIES ist typischerweise eine Erkrankung des Säuglings- und Kleinkindalters, kann aber auch Erwachsene betreffen [23, 24].
Diagnostik
Zur Diagnose von Nahrungsmittelallergien werden Sensibilisierungstests (Haut- oder IgE-Tests) eingesetzt, um einen gezielten Verdacht zu erhärten, der sich aus einer allergiezentrierten klinischen Anamnese ergibt. Im Gegensatz dazu kann eine Mehrfachtestung ohne allergiefokussierte Anamnese zum Nachweis von Sensibilisierungen führen, die stumm, das heißt ohne klinische Symptomatik sind. In der Leitlinie Management von IgE-vermittelten Erkrankungen heißt es daher: „Der Begriff „Allergietest“ (für Haut- oder IgE-Tests) ist in diesem Zusammenhang missverständlich und stellt die größte Quelle für Fehlinterpretationen diagnostischer Ergebnisse dar: Ein positives Ergebnis z. B. auf Nahrungsmittel (= Sensibilisierung) kann nur erfolgreich interpretiert werden, wenn die klinische Reaktion bekannt ist“. Für das Kindesalter wird beschrieben, dass Sensibilisierungen insbesondere auf Weizen häufig ohne klinische Relevanz auftreten [16]. Während orale Provokationstests bei Kindern bei entsprechendem Verdacht das Vorliegen einer Hühnereiallergie in fast 70 % und einer Kuhmilchallergie in 48 % bestätigen konnten, lag die Ansprechrate bei Weizen nur bei 33 % [25].
Die Diagnose von IgE-vermittelten Soforttypreaktionen erfolgt in der Regel anhand ihrer charakteristischen Symptome an Haut, Atemwegen, Gastrointestinaltrakt und Herz-Kreislaufsystem und kann gut in der Anamnese erfasst werden. Die Anamnese bei Spätreaktionen, die sich als Verschlechterung der atopischen Dermatitis manifestieren, ist jedoch oft irreführend und ein Verdacht kann nur durch eine doppelblinde, placebokontrollierte Provokation (DBPCFC) bestätigt werden [22].
Hinweis: Der Nachweis von spezifischem IgE (im Hautpricktest oder im Serum) als Ausdruck einer Sensibilisierung ist nur bei anamnestisch eindeutigen und reproduzierbaren Symptomen ein Beweis für eine Allergie. Die Beurteilung sollte daher immer im Zusammenhang mit der Anamnese, ggf. dem Ernährungs- und Symptomtagebuch und ggf. der Provokation erfolgen [22].
Zur Bestätigung des Verdachts auf eine IgE-vermittelte Weizenallergie sollte eine Bestimmung des weizenspezifischen IgE oder ein Haut-Prick-Test mit Weizenextrakt durchgeführt werden. Die Einzelallergendiagnostik ist nur von sehr begrenztem Nutzen. Eine Ausnahme bildet die Einzelallergendiagnostik bei klinischem Verdacht auf eine WDEIA. In diesem Fall sollte Tri a 19 bestimmt werden [4, 22].
Die Diagnose von nicht-IgE-vermittelten Reaktionen ist wesentlich schwieriger. Dazu gehören die eosinophile Ösophagitis (EoE) und die eosinophile Gastoenteritis (EGE). Beide Krankheitsbilder sind durch eine Gewebseosinophilie gekennzeichnet. Gleiches gilt für das FPIES (food protein induced enterocolitis syndrome), dessen akute Form durch schwere gastrointestinale Reaktionen ein bis vier Stunden nach Aufnahme des auslösenden Agens gekennzeichnet ist [24, 26].
Der Verdacht auf eine nicht-IgE-vermittelte Weizenallergie sollte durch Eliminationsdiät und offene oder doppelblinde Weizenprovokation bestätigt werden. Dabei wird der Verdacht auf das Vorliegen einer weizeninduzierten FPIES durch die typische Symptomatik (reproduzierbare schwere gastrointestinale Symptome mit Kreislaufsymptomatik, die Stunden nach dem Verzehr auftreten) gestützt. Eine Provokation sollte unter den besonderen Anforderungen der Symptomatik und der Notfallmedikation durchgeführt werden [24].
Zur Erhärtung des Verdachts auf eine Weizenallergie wird die Bestimmung des spezifischen IgE gegen Weizen oder spezifischer Weizenproteine im Blut oder ein Pricktest mit Weizenextrakt empfohlen.
Eine gezielte Einzelallergendiagnostik ist nur von begrenztem Nutzen. Ausnahmen sind spezielle Formen der Weizenallergie wie die WDEIA. Hier ist die Bestimmung des Einzelallergens Tri a 19 sinnvoll. Entscheidend für die Erhärtung eines Verdachts ist jedoch immer die Zusammenschau von anamnestisch eindeutigen und reproduzierbaren Symptomen im Zusammenhang mit einer Weizenexposition, ggf. Ernährungs- und Symptomtagebuch, Allergietestbefunden und im Zweifelsfall einer Provokation [3]. Bei WDEIA hat sich eine Provokation mit Gluten anstelle von Weizen bewährt. Diese sollte stets unter Berücksichtigung des relevanten Augmentationsfaktors erfolgen [4, 22].
Hinweis: Die Bestimmung weizenspezifischer IgG(4)-Antikörper, der Basophile-Aktivierungstest (BAT), der Histaminfreisetzungstest (HRT) sind in der Routinediagnostik nicht sinnvoll [4].
Der Verdacht auf eine weizeninduzierte FPIES wird durch die typische Symptomatik (reproduzierbare schwere gastrointestinale Symptome mit Kreislaufsymptomatik, die Stunden nach dem Verzehr auftreten) gestützt. Eine Provokation muss unter den besonderen Anforderungen der Symptomatik und der Notfallmedikation durchgeführt werden. Sie kann in der Regel offen durchgeführt werden [4, 22].
Therapie
Patientinnen und Patienten mit sicher nachgewiesener Weizenallergie sollen eine therapeutische Beratung durch einen Allergologen und eine entsprechend erfahrene Ernährungsfachkraft zur individuellen Umsetzung erhalten [4, 22]. Dabei sind die Beratungsinhalte an die spezifischen Anforderungen und Bedürfnisse der Patienten und ihres Umfeldes anzupassen und zielen darauf ab:
- allergische Reaktionen zu vermeiden,
- gegebenenfalls relevante Kofaktoren zu berücksichtigen und über deren Einfluss auf das Reaktionsgeschehen aufzuklären,
- eine bedarfsdeckende Ernährung sicherzustellen sowie
- eine bestehende Verträglichkeit und Lebensqualität zu erhalten.
Dies erfordert unter anderem eine umfassende Aufklärung über das Vorkommen, die Deklaration von loser und verpackter Ware, die Relevanz der Spurenkennzeichnung sowie eine Überprüfung der Nährstoffbedarfsdeckung und Hilfen zur Alltagsbewältigung. Bei schweren Symptomen in der Anamnese sollte ein Notfallset (einschließlich Adrenalin zur Injektion) verschrieben werden [4, 22].
Wie bei den meisten primären IgE-vermittelten Nahrungsmittelallergien im Kleinkindalter ist auch bei der frühkindlichen Weizenallergie eine Spontanremission bis zum Schulalter zu erwarten, während die WDEIA diese günstige Prognose nicht hat [4, 22].
Nicht-Zöliakie-Nicht- Weizenallergie-Weizensensitivität
Seit einigen Jahren gibt es, vor allem bei Patient*innen mit Reizdarmsyndrom, Hinweise für ein Krankheitsbild, das sich sowohl mit intestinalen als auch extra-intestinalen Symptomen nach Weizenverzehr äußert [27]. 2012 wurde das Krankheitsbild durch ein Expertenpanel als „a non-allergic and non-autoimmune condition in which the consumption of gluten can lead to symptoms similar to those seen in celiac disease“ definiert [28]. Während anfangs der Begriff der Nicht-Zöliakie-Gluten-Sensitivität (NCGS, non-celiac gluten sensitivity) verwendet wurde, wird sich langfristig vermutlich der Begriff der Nicht-Zöliakie-Weizen-Sensitivität (NCWS, non-celiac wheat sensitivity) durchsetzen, da inzwischen erhebliche Zweifel daran bestehen, dass Gluten der maßgebliche auslösende Inhaltsstoff dieses Krankheitsbildes ist [29, 30].
Per definitionem ist die NZWS durch reproduzierbare symptomatische Reaktionen auf den Verzehr weizenhaltiger (bzw. glutenhaltiger) Nahrungsmittelmittel gekennzeichnet und entspricht nicht den definierten Kriterien einer autoimmunen (Zöliakie) oder allergischen Genese (Weizen- bzw. Getreideallergie). Auch unter entsprechender Glutenbelastung sind keine Anti-Transglutaminase-IgA-Antikörper oder andere zöliakiespezifischen Antikörper oder eine zöliakietypische Histologie nachweisbar [4, 27].
Es finden sich keinerlei immunologische Sensibilisierungszeichen wie ein positiver Pricktest, spezifisches IgE auf Weizen und Gluten oder eine abnorme weizen- bzw. glutenspezifische Lymphozytenproliferation.
Klinisch findet sich eine weitestgehend unspezifische Symptomatik. Symptome treten in der Regel meist nicht alle zusammenhängend, sondern eher einzeln auf. Zöliakieähnliche Beschwerden treten meist unmittelbar (oftmals Stunden) oder einige Tage nach dem Verzehr entsprechender Lebensmittel auf und sind meist sprunghaft wechselnd (Tab. 3).
Tab. 3: Charakteristika von Zöliakie, Weizensensitivität und Weizenallergie (modifiziert nach Fasano [52]) | |||
Zöliakie | Weizen-Sensitivität | Weizenallergie | |
Prävalenz | 0,5–1,0 (2,5) % | 3–5 % ? | selten |
Anamnese | Symptome bei Verzehr von Weizen, Roggen, Gerste, Dinkel (Hafer) | Besserung unter glutenfreier Diät | multiple, unter anderem Gluten |
Zeitraum zwischen Glutenexposition und Symptomen | Wochen bis Jahre | Stunden bis Tage | Minuten bis Stunden |
Pathogenese | (Auto-)Immunität | ATI, FODMAP | Allergie |
HLA-Restriktion | HLA-DQ2/8 | keine | keine |
Serologie | IgA-anti TG2, EMAIgG-DGP | negativ | speziell IgE gegen Weizen (RAST) |
Histologie | Marsh II bis III | negativ (Gewebseosinophilie) | Gewebseosinophilie |
Klinik | (extra-)intestinal oder oligosymptomatisch | intestinal | (extra-)intestinal |
Diagnose | Symptome, Serologie,HLA-DQ2/8, Histologie | DBPC-Belastung (idealerweise) | IgE-RAST, Pricktest, DBPC-Belastung |
Therapie | strikt glutenfrei; lebenslang | Reduktion glutenhaltiger Nahrungsmittel (um > 90 %?) | strikte Meidung glutenhaltiger Nahrungsmittel |
Komplikationen | Malabsorption (refraktäre Zöliakie) | keine | allergische/anaphylaktische Reaktionen |
Abkürzungen: ATI: Amylase-/Trypsin-Inhibitoren aus glutenhaltigen Getreiden; DBPC: doppelblind und placebokontrolliert; FODMAP: fermentierbare Oligo-, Di-, Monosacchride und Polyole; TG2: Gewebetransglutaminase; EMA: Endomysium-Antikörper; DGP: Antikörper gegen deamidierte Gliadinpeptide; RAST: Radio-Allergo-Sorbens-Test; Weizen-Sensitivität: Die diagnostischen Kriterien der Zöliakie sind nicht erfüllt, aber die Symptome verbessern sich unter glutenfreier Diät. | |||
Hinweis: Bei einer Gluten-/Weizensensitivität können zwar nach dem Verzehr gluten-/weizenhaltiger Speisen ähnliche Symptome wie bei Zöliakiepatienten auftreten, doch ist das klinische Bild meist weniger ausgeprägt und es sind weder Autoantikörper noch eine Autoimmunbegleiterkrankung festzustellen. Auch weisen die Patienten im Gegensatz zu Zöliakiepatienten kaum histologische Veränderungen der Dünndarmschleimhaut oder lediglich leichte Läsionen auf.
Epidemiologie
Für die NZWS gibt es bezogen auf die Bevölkerung bisher nur grobe Schätzungen (0,5–5 %). Bei Patienten mit Reizdarmsyndrom wird eine Prävalenz von 5–20 % angenommen. Eine NZWS kann in jedem Lebensalter auftreten, Frauen sind deutlich häufiger betroffen als Männer. Prädisponierende Faktoren sind genetische Prädisposition, weibliches Geschlecht, Infektionen, allergische Erkrankungen sowie ein Verlust unspezifischer protektiver Schleimhautfaktoren [4, 27].
Ätiologie und Pathogenese
Die exakten Mechanismen der NZWS sind bis heute nicht im Detail bekannt. Es lassen sich Veränderungen der Darmpermeabilität, der intestinalen Wasser- und Elektrolytsekretion bis hin zur bakteriellen Fermentation und zur Aktivierung unspezifischer Immunmechanismen erkennen. Auch wenn sich die Symptome der NCWS unter GFD schnell bessern, ist Gluten offenbar nicht der wesentliche Auslöser im Weizen. Daher erklärt sich der klinische Benefit der GFD bei NCWS mutmaßlich durch die Elimination eines anderen Inhaltsstoffes als Gluten [4]:
- So können andere Weizenkomponenten wie z. B. Fruktane für gastrointestinale Symptome verantwortlich sein, insbesondere bei Meteorismus und abdominellen Schmerzen [27]. So konnte gezeigt werden, dass die meisten Patienten mit selbstberichteter NCWS nach sieben Tagen Provokation auf Fruktane in der Nahrung stärker mit Meteorismus reagieren als auf Gluten.
- Fruktane gehören zu der Gruppe der FODMAP (fermentierbare Oligo-, Di- und Monosaccharide und [and] Polyole), die generell als Auslöser der NCWS diskutiert wurden. Die NCWS weist von der gastrointestinalen Symptomatik starke Überschneidungen mit dem Reizdarmsyndrom (IBS) auf. Die Studienlage zu FODMAP bei IBS ist umfangreich (zwei Meta-Analysen) und zeigt einen Vorteil für die zumindest kurzfristige Wirksamkeit der FODMAP-armen Diät. Der langfristige Einsatz ist aber umstritten und ein genereller Verzicht auf Lebensmittel mit einem hohen FODMAP-Gehalt auch ernährungsphysiologisch nicht sinnvoll. In mehreren Studien wurde auch die Reduktion der günstigen Bifidobakterien im Darm beschrieben, daher ist längerfristig eine Dysbiose unter Low-FODMAP zu vermuten [31].
- Darüber hinaus könnten Amylase-Trypsin-Inhibitoren (ATI), die in Getreidearten natürlich vorkommen, zu klinischen Symptomen bei NCWS beitragen [3, 4]. Der Gehalt an ATI ist in Getreiden sehr unterschiedlich und kann auch in alten Getreidesorten hoch sein (z. B. Emmer). Für das diploide Einkorn wurden keine der in moderneren (tetra- und hexaploiden) Weizen vorkommenden ATI nachgewiesen [32, 33]. ATI aktivieren in vitro und im Tierversuch das angeborene Immunsystem über den Toll-like Rezeptor 4 (TLR4) auf insbesondere Monozyten, Makrophagen und dendritischen Zellen [32].
- Mit der industriellen Revolution wurden natürliche Lebensmittel auf Weizenbasis immer weiter verarbeitet. Hochprozessierte Weizenprodukte sind heutzutage routinemäßiger Bestandteil unserer Ernährung. Da unser genetischer Hintergrund nicht angepasst ist für diese Ernährungsform, besteht offenbar bei einem nicht unerheblichen Teil der Bevölkerung eine verminderte Verträglichkeit der Produkte [34]. Genannt seien hier exemplarisch für mögliche Auslöser von Unverträglichkeiten durch den Verarbeitungsprozess: Höhere Knetintensitäten der Teige, Backpulver zur Verringerung der Gehzeit, Lebensmittelzusatzstoffe wie z. B. vitales Gluten.
Diagnostisches Vorgehen
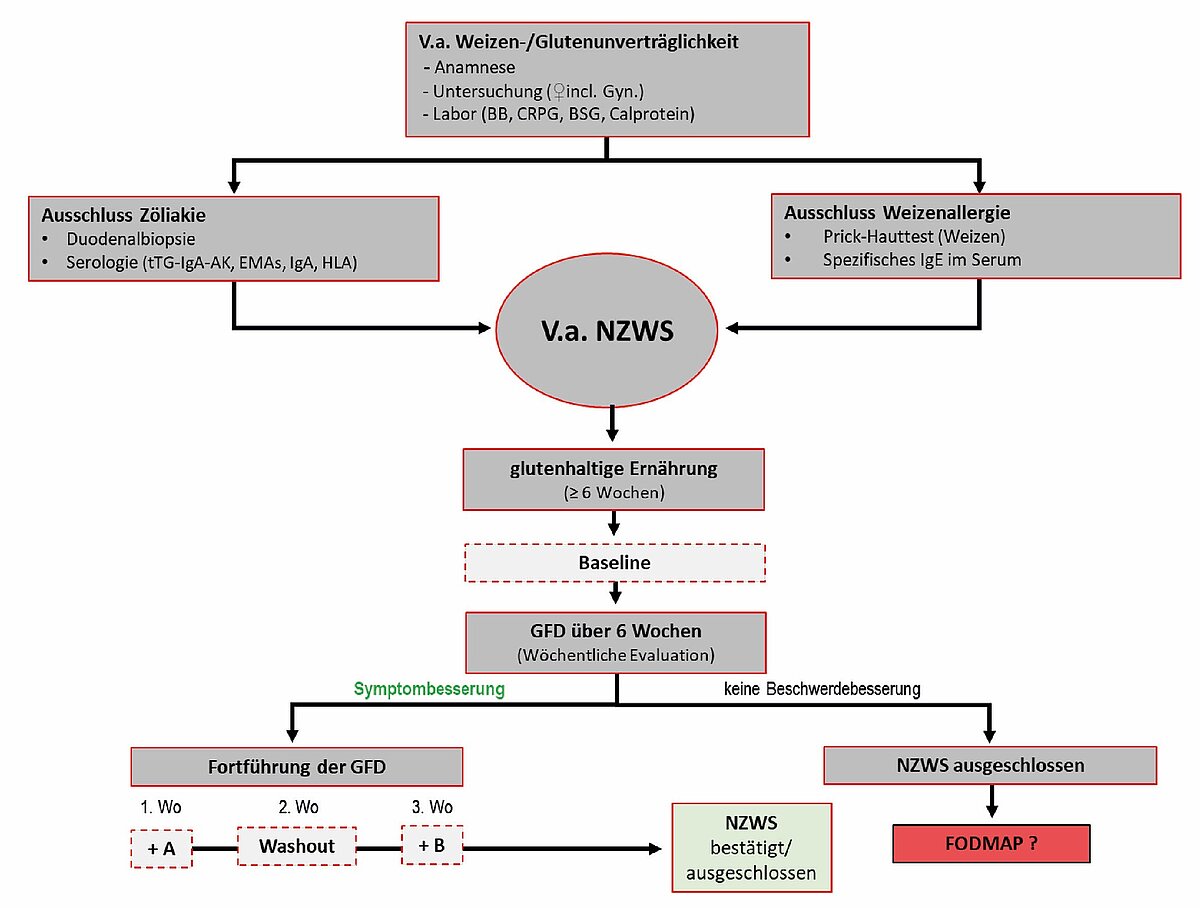
Die Verdachtsdiagnose NCWS kann erst weiterverfolgt werden, wenn Weizenallergien und vor allem eine Zöliakie endgültig ausgeschlossen sind. Da Patientinnen und Patienten bereits häufig eine selbst auferlegte glutenbeschränkte Diät einhalten, sollte eine Glutenbelastung erfolgen, bevor die Zöliakiediagnostik durchgeführt wird. Auch unter den gängigen Low-Carb Diäten, ketogener Kost, Paläodiät etc. kann keine ausreichende Glutenbelastung für eine aussagekräftige Zöliakie-Ausschlussdiagnostik gewährleistet werden. Daher muss die Menge an aufgenommenem Gluten vor der Ausschlussdiagnostik abgeschätzt werden und ggf. eine Glutenbelastung erfolgen [27].
Über ein Ernährungs- und Symptomtagebuch kann überprüft werden, ob Weizen bzw. Inhaltsstoffe des Weizens tatsächlich reproduzierbare Symptome hervorrufen. Nur wenn das der Fall ist, ist eine therapeutische Eliminationsdiät zu erwägen. Ggf. kann eine zeitlich limitierte Elimination glutenhaltiger und damit auch ATI-haltiger Lebensmittel erfolgen. Nach einer sechswöchigen glutenfreien Ernährung (GFD) sollten die wichtigsten klinischen Symptome wesentlich und dauerhaft verbessert sein, messbar durch validierte Fragebögen (Abb. 5).
Behandlungsmethoden bei NCWS
Anzustreben ist eine individuelle, symptomorientierte, ernährungstherapeutische Beratung mit Vermeidung bzw. Reduktion der individuell relevanten Auslöser. Die pauschale Durchführung von Diäten wie GFD, Low-FODMAP oder histaminarmer Kost ist dagegen nicht sinnvoll [4, 27]. Sollte trotz aller Unsicherheiten und nach sicherem Ausschluss einer Zöliakie die GFD als Therapieoption bei Verdacht auf NCWS eingesetzt werden, ist in der Regel nach sechs bis acht Wochen strikter Elimination glutenhaltiger Lebensmittel die Einhaltung einer glutenreduzierten Kost möglich. Denn sehr häufig tolerieren NCWS-Patienten geringe Mengen dieser Nahrungsmittel. Die Schwellenwerte sind jedoch sehr unterschiedlich und sollten individuell abgeklärt und angepasst werden. Grundsätzlich ist eine glutenreduzierte Kost einer glutenfreien Kost vorzuziehen, unter anderem auch, um das Triggern eines zwanghaftem Essverhalten wie der Orthorexia nervosa vorzubeugen [4, 35, 36]. Darüber hinaus können mit einer GFD Risiken und Nachteile (siehe unten) verbunden sein, die ggf. im Rahmen der ernährungstherapeutischen Beratung thematisiert und denen dann gezielt entgegengewirkt werden sollten [4].
50 Jahre Deutsche Zöliakie-Gesellschaft
Die Deutsche Zöliakie-Gesellschaft e. V. (DZG) feiert in diesem Jahr das 50-jährige Bestehen. Der gemeinnützige Verein wurde 1974 als Selbsthilfeorganisation von Eltern an Zöliakie erkrankten Kindern gegründet. Die DZG ist eine Solidargemeinschaft, in der Menschen, die von Zöliakie und Dermatitis herpetiformis Duhring (DHD) betroffen sind, Hilfe und Unterstützung für ihr tägliches Leben finden.
Inzwischen ist die DZG auf über 40.000 Mitglieder gewachsen und informiert auf vielen Ebenen über Zöliakie und die Bedürfnisse der Betroffenen. Sie ist Mitglied der AOECS (Association of European Coeliac Societies), der gemeinsamen Vertretung der Interessen der Zöliakiebetroffenen in Europa.
Im Internet: www.dzg-online.de
Risiken und Nachteile einer glutenfreien Diät
Die Popularität der glutenfreien Ernährung ist aus medizinischer Sicht nicht unproblematisch. Wie eine Metaanalyse von Vici et al. gezeigt hat, kann eine glutenfreie Ernährung zu relevanten Nährstoffdefiziten führen. Dazu gehören z. B. ein Mangel an Vitamin D, Vitamin B12 und Folsäure [37–41].
Zahlreiche Studien weisen darauf hin, dass eine Zöliakie zu einer verminderten Aufnahme von Ballaststoffen und einer erhöhten Aufnahme von Stärke, Zucker und/oder Fett, insbesondere gesättigten Fettsäuren, führen kann und damit das Risiko für ernährungsbedingte Folgeerkrankungen (metabolisches Syndrom, koronare Herzkrankheit) erhöht [41, 42.]
Darüber hinaus können insbesondere reisbasierte glutenfreie Produkte mit schädlichen Inhaltsstoffen, unter anderem Schwermetallen wie Arsen, Blei, Cadmium und Quecksilber belastet sein, und Personen, die eine GFD einhalten, haben höhere Konzentrationen von Arsen im Urin sowie von Blei, Cadmium und Quecksilber im Blut als Personen, die eine glutenhaltige Diät einhalten [43–45].
Der Grund: Reispflanzen nehmen Giftstoffe wie Arsen über die Wurzel auf und reichern sie im Reiskorn an. Das Mehl wird von Herstellern glutenfreier Produkte als Ersatz für herkömmliches Weizenmehl verwendet. In Untersuchungen fallen Reis und daraus hergestellte Lebensmittel wie Reiswaffeln seit Jahren durch erhöhte Schadstoffbelastungen auf.
Das Bundesinstitut für Risikobewertung (BfR) empfiehlt, Produkte wie Reiswaffeln oder Reisflocken/Reisbrei nur in Maßen zu verzehren und Säuglinge und Kleinkinder nicht ausschließlich mit reisbasierten Getränken wie Reisgetränken oder Beikost wie Reisbrei zu ernähren [45]. Bei der Auswahl glutenfreier Getreidearten sollte daher eine einseitige Ausrichtung auf Reis und Reisprodukte vermieden werden.
Prof. Dr. oec. troph. Dr. med. Jürgen Stein, Klinik Innere Medizin mit Schwerpunkt Gastroenterologie, Ernährungsmedizin, Krankenhaus Sachsenhausen, Schulstraße 31, 60594 Frankfurt E-Mail: j.stein@em.uni-frankfurt.de
PD Dr. med. Michael Schumann, Medizinische Klinik I für Gastroenterologie, Infektiologie und Rheumatologie, Charité – Universitätsmedizin Berlin Campus Benjamin Franklin, Hindenburgdamm 30, 12200 Berlin; E-Mail: michael.schumann@charite.de
Die Literaturangaben finden Sie hier.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Krank durch Weizen? Zöliakie, Weizenallergie, Nicht-Zöliakie-Weizensensitivität – wo liegen die Unterschiede?“ von Prof. Dr. oec. troph. Dr. med. Jürgen Stein und PD Dr. med. Michael Schumann finden Sie nachfolgend abgedruckt und im Portal sowie in der PDF-Version dieses Artikels. Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Portal vom 25. Mai 2024 bis 24. November 2024 möglich. Die Fortbildung ist mit drei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.
Abkürzungsverzeichnis | |
APC | antigenpräsentierende Zellen: vor allem Monozyten, Makrophagen, B-Zellen und dendritische Zellen |
ATI | Amylase-Trypsin-Inhibitoren aus glutenhaltigen Getreiden |
BAT | Basophile-Aktivierungstest |
BfR | Bundesinstitut für Risikobewertung |
DBPCFC | doppelblinde, placebokontrollierte Provokation |
DGP | Antikörper gegen deamidierte Gliadinpeptide |
DGVS | Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten |
EGE | eosinophile Gastoenteritis |
EMA | Endomysium. Bei Endomysium-Antikörper handelt es sich um Antikörper der Klasse IgA und IgG, die sich gegen Proteinkomponenten des Endomysiums richten. Sie kommen bei Patienten mit Zöliakie nach Aufnahme glutenhaltiger Nahrungsmittel vor und lassen sich daher zum diagnostischen Nachweis nutzen. |
EoE | eosinophile Ösophagitis |
FPIES | Food-Protein Induced Enterocolitis Syndrom |
FODMAP | fermentierbare Oligo-, Di- und Monosaccharide und [and] Polyole |
GFD | glutenfreie Diät |
GWAS | genomweite Assoziationsstudie (GWAS, engl. Genome-wide association study) – eine Untersuchung der genetischen Variation des Genoms eines Organismus |
HLA-Klasse Gene | Humane Leukozytenantigen-System: Gruppe menschlicher Gene, die für die Funktion des Immunsystems zentral sind. |
HRT | Histaminfreisetzungstest |
IBS | Reizdarmsyndrom, Irritable Bowel Syndrome |
IEL | intraepitheliale Lymphozyten |
IgA | Immunglobulin A |
IgG | Immunglobulin G |
IL-15 | Interleukin-15-Rezeptor |
NCGS (älterer Begriff), heute NCWS | non-celiac gluten sensitivity |
NCWS/NZWS | non-celiac wheat sensitivity, Nicht-Zöliakie-Weizensensitivität |
RAST | Radio-Allergo-Sorbens-Test |
RZ | refraktäre Zöliakie |
TG2 | Gewebetransglutaminase |
WDEIA | wheat dependent exercise-induced anaphylaxis |