Prof. Dr. med. Lothar Thomas, Dr. med. Gudrun Hintereder
Einleitung
Nach traditioneller Sichtweise beruht die Diagnostik des Eisenmangels vorwiegend auf dem Befund einer mikrozytären hypochromen Anämie. Ein Mangel an Eisen kann bei Patienten ohne Entzündung auf einer zu geringen Aufnahme von Eisen mit der Nahrung oder dem Verlust von Eisen durch Blutung (z. B. kolorektales Karzinom) beruhen.
Bei Erkrankungen mit chronischer Entzündung (Anemia of chronic disease; ACD) ist die Ursache der Anämie eine mangelnde Verfügbarkeit von Eisen. Obwohl bei ACD der Eisengehalt des Organismus normal oder gar erhöht ist, steht es den Funktionsstellen wie der Erythropoese zur Bildung von Hämoglobin (Hb), den Muskelzellen zur Bildung von Myoglobin und den Enzymen, die in den Mitochondrien für die Energiegewinnung verantwortlich sind, nicht zur Verfügung. Die Ursache liegt darin, dass Eisen bei ACD in Makrophagen des retikuloendothelialen Systems und den Hepatozyten der Leber sequestriert wird. Die entzündungsbedingte Sequestration führt, wie der nutritive Eisenmangel, zu einer Anämie und Verminderung mit Lebensqualität.
| Tab. 1: Untersuchungen zur Diagnostik und Differenzierung der Eisenverfügbarkeit | |
| Hb-Wert | Hb-Werte, unterhalb derer eine Anämie durch mangelnde Eisenverfügbarkeit besteht, sind nach WHO bei Männern < 13 g/dl, bei Frauen < 12 g/dl, bei Schwangeren < 11 g/dl. Das erythozytäre Volumen (MCV) und der erythrozytäre Hb-Gehalt (MCH) sind bei der Eisenmangelanämie vermindert. |
| Ferritin | Der Serumferritinwert reflektiert den Speichereisengehalt. 1 μg/l sind repräsentativ für 8–10 mg Speichereisen. Im Vergleich zum Goldstandard, dem Eisengehalt im Knochenmarkaspirat, klassifiziert ein Ferritinwert ≤ 15 μg/l leere Eisenspeicher [13]. Höhere Ferritinwerte, insbesondere bis zu einem Grenzwert von 30 μg/l, reflektieren zu etwa 70 % verminderte Eisenspeicher und erfordern eine Behandlung mit Eisen. Ferritin ist ein Akute-Phase-Protein und bei einer ACD ist die Beziehung zwischen Serumwert und Speicher- eisengehalt nicht mehr gegeben. Die Patienten haben in der Regel Ferritinwerte > 100 μg/l und volle Eisenspeicher, aber ein vermindertes Funktionseisen, die TfS (siehe nächste Zeile) ist < 16 %. |
| Transferrin- Sättigung (TfS) | Die TfS ist ein Parameter des Funktionseisens und bei Eisenmangelanämie vermindert. Bei normaler Versorgung der Funktionsstellen mit Eisen beträgt die TfS 16–40 %. Bei Vorliegen einer ACD gibt die TfS keine Auskunft zum Funktionseisen, denn Transferrin ist ein negatives Akute-Phase Protein und bei der ACD erniedrigt. Die Blutentnahme zur Bestimmung der TfS sollte generell morgens und nüchtern erfolgen. |
| Zink-Protoporphyrin (ZPP) | Zink wird in Protoporphyrin 9, dem letzten Schritt der Synthese des Porphyrinrings, gebunden, falls kein Eisen verfügbar ist. Anstatt eines Moleküls Eisenprotoporphyrin entsteht ein Molekül ZPP. Personen mit Speichereisenmangel haben normale ZPP-Werte (≤ 40 μmol/mol Hb). Wird die Erythropoese nicht mehr ausreichend mit Eisen versorgt, steigt der ZPP-Anteil in Relation zum Hb kontinuierlich an. Das frühe Stadium einer mangelnden Eisenversorgung wird nicht erfasst. Das ZPP ist ein Screeningparameter des Eisenmangels, aber ungeeignet zur Differenzierung der in Tab. 2 genannten Zustände einer mangelnden Eisenverfügbarkeit [14]. |
| Löslicher Transferrin-Rezeptor (sTfR) | Der lösliche Transferrinrezeptor (engl. soluble transferrin receptor; sTfR) ist die freigesetzte verstümmelte Form des Zellwand-gebundenen Transferrinrezeptors (TfR). Die Funktion des TfR besteht darin, Eisen in kernhaltige Körperzellen, insbesondere Erythroblasten und Retikulozyten zu transportieren [15]. Der TfR wird von den Zellen abgeworfen und erscheint im Blut, wenn das Funktionseisen vermindert ist. Der sTfR-Serumwert hat eine der TfS vergleichbare diagnostische Wertigkeit, ist aber im Unterschied zur TfS auch bei der ACD ein Indikator des Funktionseisen, da er nicht durch eine Entzündung beeinflusst wird. Besteht bei ACD ein Mangel an Funktionseisen, so ist der sTfR erhöht. |
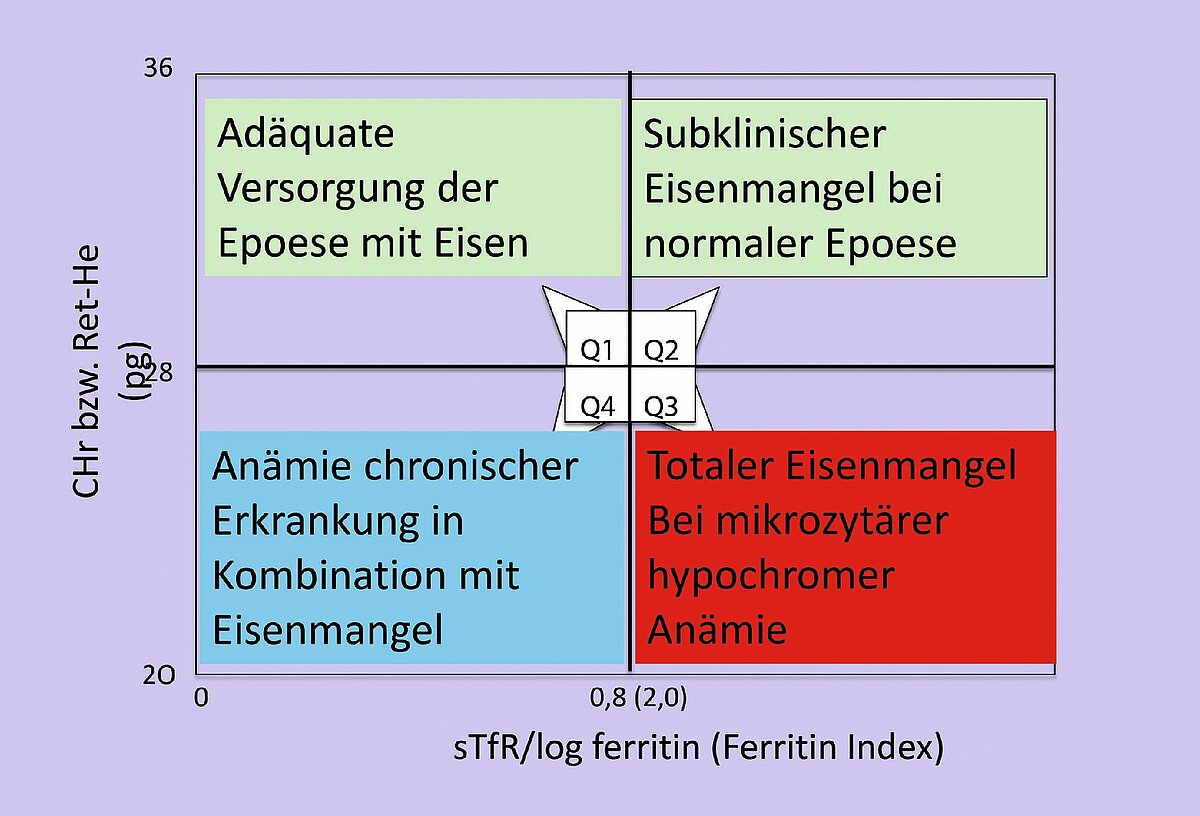
| Ferritinindex (FI) Diagnostischer Eisenblot | Der FI = sTfR (mg/l)/log10 Ferritin (μg/l) verbindet die Messung von Ferritin mit der des sTfR. In Kombination mit dem Ret-He bzw. CHr in einem multivariablen System (diagnostischer Eisenblot) ist der FI ein Marker zur Differenzierung des Eisenstatus in folgende vier Stadien: Normale Eisenversorgung, subklinischer Eisenmangel, totaler Eisenmangel und Kombination von ACD und Eisenmangelanämie [10]. Viele Laboratorien bieten im Internet die Berechnung des Eisenstatus anhand des Eisenblots an. |
| Hypochrome Erythrozyten (%HYPO) | Der prozentuale Anteil an Erythrozyten mit einer Hb-Konzentration < 28 g/dl ist ein Marker, der mittelfristig im dreimonatigen Lebenszyklus des Erythrozyten, den Eisenbedarf der Erythropoese anzeigt. Bei mangelnder Eisenversorgung resultiert eine Zunahme der %HYPO ab der vierten Woche. Die %HYPO sind bei Patienten mit mangelnder Eisenversorgung erhöht [16]. Ein Nachteil der %HYPO ist, dass die Bestimmung spätestens sechs Stunden nach der Blutentnahme erfolgen muss und nicht alle Hämatologieanalysatoren die %HYPO messen. |
| Retikulozyten-Hämoglobin (Ret-He, CHr) | Retikulozyten-Hämoglobin, messbar als CHr oder Ret-He, reflektiert das für die Erythropoese verfügbare Eisen [17]. Die Parameter sind bei einer Eisenmangelanämie und der Kombination von ACD und Eisenmangel < 28 pg. Werden %HYPO und CHr bzw. Ret-He aus einer Probe bestimmt, entsprechen sie dem Monitoring von HbA1c und Glucose beim Diabetes mellitus. Isoliert erniedrigtes CHr bzw. Ret-He weist auf eine mangelnde Eisenversorgung innerhalb der vergangenen drei bis vier Tage hin, ein zusätzlich erhöhtes %HYPO zeigt an, dass der Mangel schon seit mehr als drei Wochen besteht. CHr bzw. Ret-He sind für zwei Tage bei Zimmertemperatur stabil. |
| Hepcidin | Die Bestimmung von Hepcidin-25 ermöglicht keine klare Abgrenzung der Zustände mit mangelnder Eisenversorgung und ist für die Routinediagnostik noch nicht zu empfehlen. |
Eisenstoffwechsel
Eisen ist essenziell für viele Funktionen des Organismus. Im Hb der Erythrozyten bindet es reversibel Sauerstoff, auch ist es der wesentliche Bestandteil des muskulären Myoglobins. Nicht an Häm gebundenes Eisen in Enzymen ist essenziell für die Energie produzierenden Redoxreaktionen in den Mitochondrien und für die DNS-Synthese. Beim Eisenstoffwechsel wird die systemische von der zellulären Regulation unterschieden. Störungen der Ersteren können gut durch Laboruntersuchungen diagnostiziert und die Therapie kontrolliert werden. Das ist beim zellulären Eisenstoffwechsel nicht der Fall, denn es sind noch keine Routineuntersuchungen verfügbar.
Die systemische Regulation des Eisenhaushalts ist in Abb. 1 aufgeführt. Der Ablauf geschieht wie folgt: In der Leber wird die Eisenkonzentration des Bluts gemessen und bei erniedrigtem Wert die Bildung des Eisen-regulierenden Hormons Hepcidin unterdrückt. Eine niedrige Konzentration von Eisen führt zu einem niedrigen Wert von Hepcidin im Blut. Dadurch wird die Absorption von Nahrungseisen aus dem Darm und die Freisetzung von Eisen aus den Speichern in den Hepatozyten und den Makrophagen des retikulo-endothelialen Systems (RES) erhöht [1]. Die Eisenkonzentration im Serum steigt an und die Verteilung von Eisen an die Funktionsstellen ist erhöht. Auch steigert ein niedriger Hepcidinwert die Proliferation der Erythropoese, während ein erhöhter Wert, der bei einer ACD vorliegt, den Eisengehalt im Blut und die Proliferation der Erythopoese reduziert.
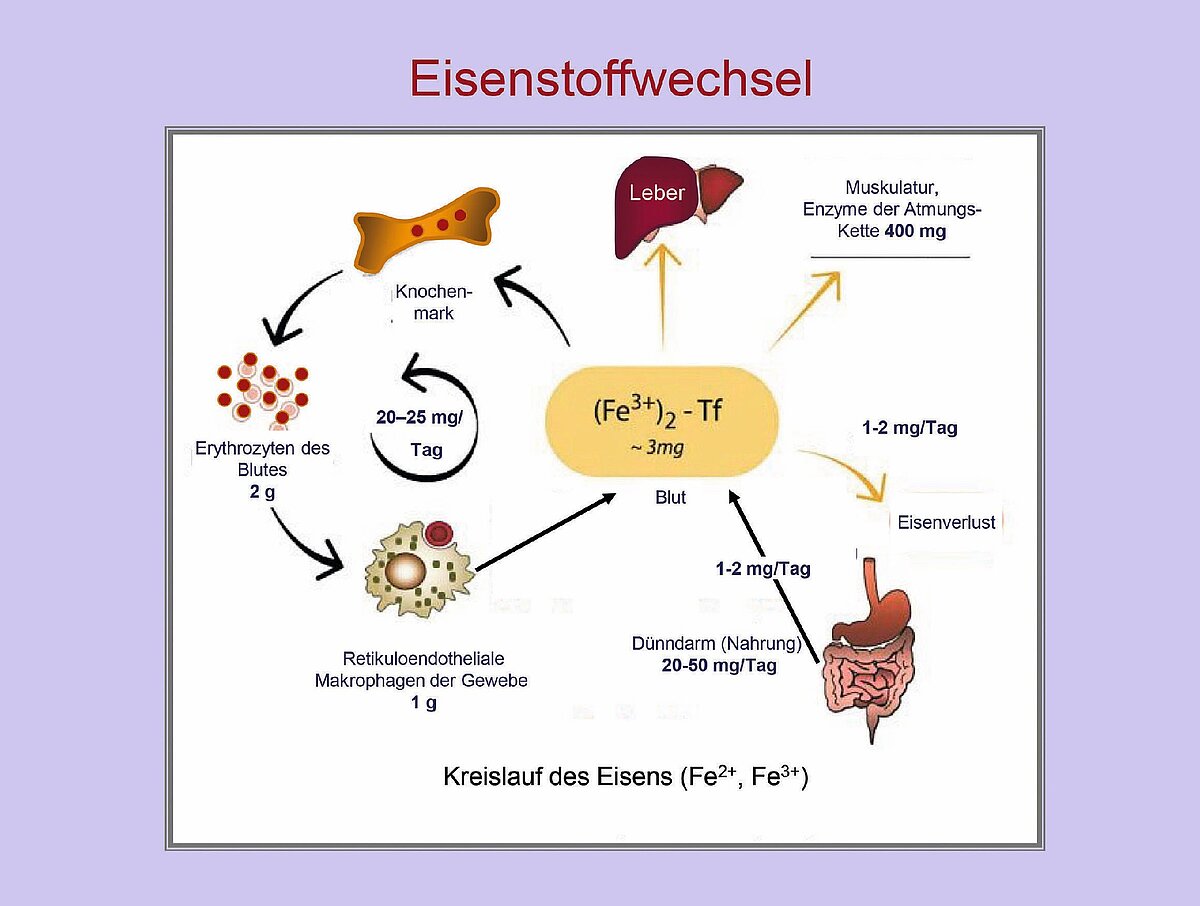
Die zelluläre Regulation des Eisenstoffwechsels wird durch zytoplasmatische Eisen- regulatorische Proteine (IRP) und Eisen-regulierende Elemente (IREs) gesteuert. Sie regulieren den zellulären Gehalt des Eisenspeicherproteins Ferritin, des Eisentransportproteins Transferrin und des Transferrinrezeptors, der Eisen in die Zellen transportiert [2].
Absorption von Eisen
Männer absorbieren etwa 1 mg Eisen/Tag, prämenopausale Frauen 1,3–1,5 mg/Tag und Mehrfachblutspender 4–5 mg/Tag. Die Absorptionsmenge ist vom Eisenbedarf abhängig und nimmt bei akuter Hypoxie zu. Nach der enteralen Absorption verbleibt das Eisen als Ferritin im Enterozyten des Darms. Besteht kein Eisenbedarf wird Eisen mit alternden Enterozyten innerhalb von 7 Tagen abgestoßen und verlässt den Körper über den Stuhl. Der Eisenverlust mit dem Stuhl ist eine wichtige Ursache der Anämie bei chronisch entzündlichen intestinalen Erkrankungen [3]. Besteht Eisenbedarf übernimmt Transferrin das Eisen vom Enterozyten und transportiert es zu den Funktionsstellen. Nicht benötigtes Eisen wird als Ferritin in den Hepatozyten und dem RES gespeichert. Die Ferritinkonzentration im Blut steht mit der Eisenspeicherung im Gleichgewicht und ist der Indikator des gespeicherten Eisens. Das ist nicht mehr der Fall, wenn eine chronische Entzündung vorliegt, denn Ferritin ist neben seiner Funktion als Indikator des Speichereisens auch ein Akute-Phase Protein. Jedoch schließen Ferritinwerte > 300 μg/l auch bei chronischer Entzündung den Eisenmangel aus [4].
Erythropoese und Eisen
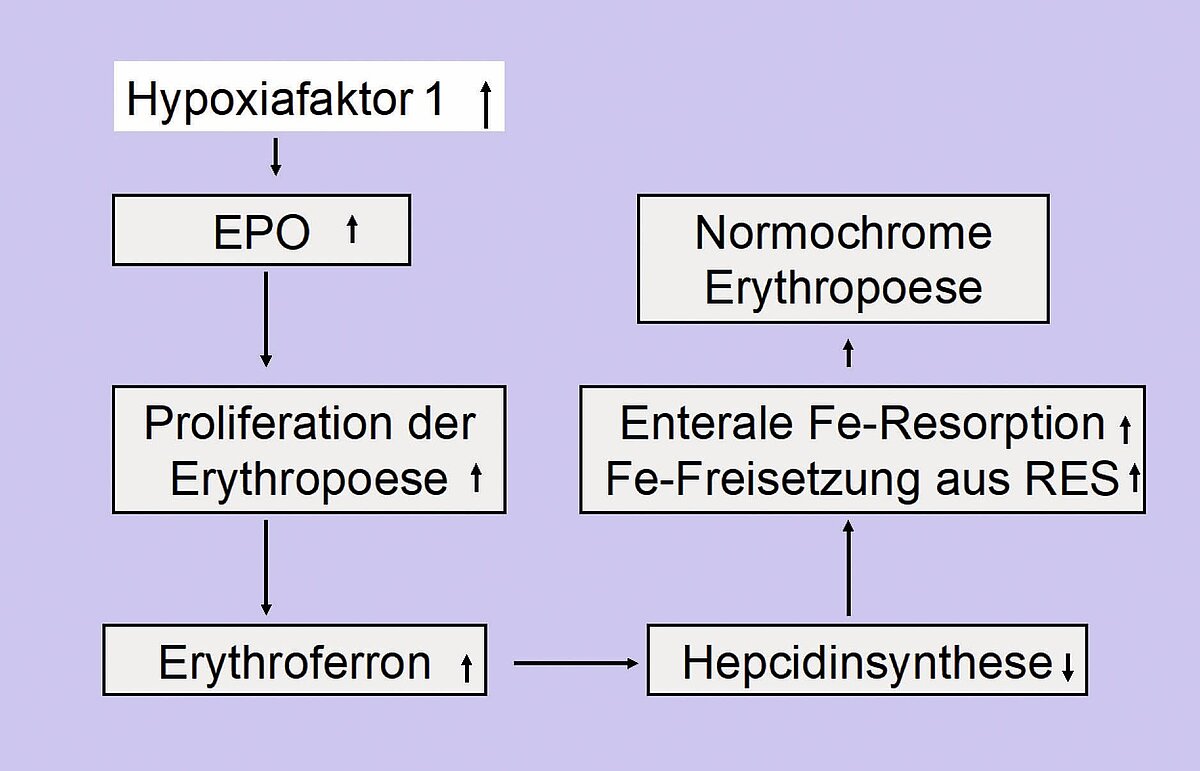
Die Eisenversorgung der Erythropoese ist beim nutritiven Eisenmangel, nach einer Blutung und Bedingungen, die eine Stress-erythropoese bewirken, begrenzt [5]. 1 g Hämoglobin enthält 3,46 mg Eisen und beim Verlust von 1 ml Blut (Hb 15 g/dl) gehen 0,5 mg Eisen verloren. Bei der Blutungsanämie führt ein Mangel der Sauerstoffsättigung zur Bildung des Hypoxiafaktors 1, der die Erythropoetinsekretion aktiviert [6]. Erythropoetin stimuliert die Proliferation des Knochenmarks, wodurch der Eisenbedarf um das Mehrfache gesteigert wird. Hyperproliferatives Knochenmark bildet Erythroferron, das in der Leber die Hepcidinbildung herunterreguliert, und Eisen wird verstärkt intestinal absorbiert und aus Speichern freigesetzt (Abb. 2). Somit wird der Erythropoese ausreichend Eisen zur Wiederherstellung der Sauerstofftransportkapazität zur Verfügung gestellt [7]. Gelingt das nicht, wird das Funktionseisen rasch verbraucht und die Eisenversorgung für die Bildung von Hb und anderer Eisen abhängiger Funktionsstellen vermindert. Es resultiert die Bildung hypochromer Erythrozyten und eine Einschränkung des zellulären Metabolismus wichtiger Organe wie Herz, Leber, Nieren, Muskulatur und Gehirn.
Komorbiditäten
Der Eisenmangel wird häufig als Komorbidität bei vielen Erkrankungen diagnostiziert. Frauen im gebärfähigen Alter haben dreimal häufiger einen Eisenmangel als Männer. Auch ohne Anämie kann eine verminderte Eisenversorgung mit Störungen im Zentralnervensystem assoziiert sein (neuromuskuläre Funktion, Müdigkeit, geringes Belastungsvermögen, neurokognitive Störung). Erkrankungen, die zur ACD gezählt werden wie Infektionen, Autoimmunerkrankungen, metastasierte Tumoren, chronische Nierenerkrankung, aber auch Diabetes mellitus, Bluthochdruck und chronische kardiale Erkrankungen vermindern die Bildung von Erythropoetin [8] und fördern die Ausbildung einer Anämie.
Eisenmangel bei Vegetariern
Eine gut geplante vegetarische Diät ist kompatibel mit einem normalen Eisenstatus. Das ist in den westlichen Nationen mit der Vielfalt der angebotenen Nahrungsmittel leichter als in den Entwicklungsländern, bei denen ungeschälte und nicht verfeinerte Nahrungsmittel vorherrschen. Denn Phytate und Polyphenole der pflanzlichen Nahrungsmittel hemmen die enterale Aufnahme von nicht an Häm gebundenen Eisen.
Vegetarier haben eine höhere Prävalenz an leeren Eisenspeichern und Eisenmangelanämie als Nicht-Vegetarier. So hatten in einer Studie 21 % der Vegetarier einen Mangel an Speichereisen, aber nur 7 % derjenigen mit Fleischkonsum. Der Speichereisenmangel ist besonders häufig bei Kindern und prämenopausalen Frauen [9].
| Tab. 2: Zustände mangelnder Eisenversorgung | |
| Subklinischer Eisenmangel | Es liegt keine Anämie vor. Das Gesamtkörpereisen ist vermindert durch leere Eisenspeicher, das Funktions- eisen (Transferrin gebundenes Eisen) ist noch normal. Das Blutbild entspricht dem bei normaler Eisenversorgung. Laborbefunde: Normales Blutbild, Ferritin ≤ 30 μg/l, TfS > 16 %. |
| Totaler Eisenmangel | Es besteht eine mikrozytäre hypochrome Anämie (MCV, MCH erniedrigt). Die Erythropoese ist hypoproliferativ (Retikulozytenzahl < 50 x 109/l). Das Gesamtkörpereisen ist vermindert (Eisenspeicher leer, Funktionseisen vermindert, Eisen benötigende Funktionsstellen sind Eisen-defizient). Laborbefunde: Ein Ferritinwert < 15 μg/l bestätigt den totalen Eisenmangel mit einer diagnostischen Sensitivität von 75 % bei einer Spezifität von 95 % [18], ein Wert < 30 μg/l mit einer diagnostischen Sensitivität von 92 % bei einer Spezifität von 58 % [19]. Ein TfS-Wert < 16 % weist auf den Mangel an Funktionseisen hin. |
| Anämie chronischer Erkrankung (ACD, Anemia of chronic disease) | Es besteht eine Anämie. Ursachen sind chronische Erkrankungen mit Inflammation wie Infektionen, autoimmune Erkrankungen, metastasierte Karzinome und die chronische Niereninsuffizienz [8]. Bei der ACD, auch als Eisen-Sequestrationssyndrom bezeichnet, sind die Eisenspeicher (Hepatozyten, Makrophagen des RES) gefüllt, aber Eisen ist sequestriert und wird nicht bei Bedarf an Transferrin übergeben. Auch ist die enterale Eisenabsorption vermindert. Ursachen sind inflammationsbedingte erhöhte Hepcidinwerte, die den Eisenexport aus dem RES, die Abgabe von enteral absorbiertem Eisen in das Blut und die Proliferation der Erythropoese hemmen. Laborbefunde: Normozytäre bis leicht hypochrome Anämie solange durch Blutung kein Eisen verloren geht. Ist das aber der Fall, dann mikrozytäre hypochrome Anämie mit Hb-Werten Werten von im Mittel 10 g/dl. Verminderung der Erythrozytenzahl. Ferritin bei ACD in der Regel > 100 μg/l, TfS < 16%. Für den Kliniker besteht das Dilemma zu untersuchen, ob der Ferritinwert und die TfS auf einem Eisenmangel oder einer ACD beruhen. Sind der sTfR oder Ret-Hb bzw. CHr normal, so handelt es sich um eine ACD. |
| Funktioneller Eisenmangel | Der funktionelle Eisenmangel ist die Folge einer endogenen Erythropoetinantwort auf einen starken Blutverlust oder resultiert aus der Therapie einer Anämie mit Erythropoese-stimulierendem Agenz (ESA) ohne ausreichende parenterale Eisenzufuhr. Transient ist der Organismus nicht fähig, für eine stark hyperproliferative Erythropoese genügend Eisen bereit zu stellen. Laborbefunde: Ferritin normal, TfS stark vermindert. |
Bestimmung der Verfügbarkeit von Eisen
Die Eisenversorgung der Funktionsstellen wird traditionell durch die Bestimmung des Blutbildes, von Ferritin und der Transferrinsättigung (TfS) ermittelt. Die Aussagekraft dieser Untersuchungen ist aber begrenzt auf den nutritiven Eisenmangel und den Eisenmangel durch Blutverlust. Die biochemischen Marker löslicher Transferrinrezeptor (sTfR), Ferritinindex (FI) sowie die hämatologischen Indices %HYPO (Anteil der hypochromen Erythrozyten) und der Hämoglobingehalt der Retikulozyten (CHr bzw. Ret-He ) sind weiterführend differentialdiagnostisch von Bedeutung (Tab. 1).
Managementsysteme zur Diagnostik der Verfügbarkeit von Eisen
Die Zustände mangelnder Eisenversorgung sind beschrieben in Tab. 2. Zur Diagnose und Klassifizierung der Ursachen muss der Patient insgesamt untersucht werden. Insbesondere beachtet werden müssen Entzündung, Infektion, okkulter Blutverlust und die Nahrungsgewohnheiten.
Bei Vorliegen einer ACD erfordert die Differenzierung des Eisenstoffwechsels und die Indikation einer Therapie die Bestimmung zusätzlicher Marker und die Auswertung vermittels eines multivariablen Systems [10] wie den diagnostischen Eisenblot (Abb. 3).
Kontrolle der oralen Eisentherapie
Eine optimale Therapieresponse liegt vor bei [11]:
- Anstieg der TfS nach etwa zehn Tagen – ein kontinuierlicher Wert > 16 % bedeutet, dass genügend Funktionseisen vorhanden ist.
- Zunahme des Hb-Wertes um etwa 1 g täglich in der 2.–3. Therapiewoche.
- Normalisierung des Ferritinwertes nach zwei bis drei Monaten.
- Anstieg der Retikulozytenzahl nach etwa zehn Tagen um mindestens 20 %.
- Anstieg von CHr bzw. Ret-He innerhalb von einer Woche. Eine Normalisierung von CHr bzw. Ret-He im Verlaufe der Behandlung bedeutet nur eine ausreichende Versorgung der Erythropoese, nicht aber, dass die Eisenspeicher gefüllt sind.
- Abfall der sTfR-Konzentration um > 20 % nach etwa zehn Tagen.
Kontrolle der parenteralen Eisentherapie
Der parenteralen Eisentherapie wird der Vorzug gegeben in Situationen, bei denen hohe Hepcidinwerte eine orale Therapie beeinträchtigen, z. B. bei ACD [12]. Zu beachten ist, dass hohe parenterale Bolusgaben von Eisen nur eine begrenzte Wirkung haben. Ursache ist, dass der größte Teil des zugeführten Eisens rasch von der Leber aufgenommen und in Makrophagen sequestriert wird. Durch die Sequestrierung wird eine schon bestehende Hepcidinerhöhung noch gesteigert und verstärkt Eisen sequestriert [12].
Erhalten bei postpartaler Anämie Frauen mit einem Hb-Wert < 10 g/dl jeweils 200 mg Eisensucrose an den Tagen 1–4, so zeigen die Kontrollparameter am 7. Tag im Vergleich zum Ausgangswert im Mittel einen Hb-Anstieg um 1,5 g/dl, eine Zunahme der Retikulozytenzahl und einen Anstieg der TfS um 50 % und etwa die fünffache Zunahme des Ferritinwertes.
Cave: Die intravenöse Gabe von Eisen muss sehr langsam und unter kritischer Beobachtung sowie in Notfalltherapiebereitschaft für mögliche allergische oder allergoide Reaktionen verabreicht werden.
Fazit
- Die mangelnde Eisenversorgung ist sehr viel häufiger als die Eisenmangelanämie.
- Die Zustände mangelnder Eisenversorgung müssen vor Beginn einer Eisentherapie unterschieden werden.
- Die Bestimmung von Ferritin und der Transferrinsättigung sind ungenügend zur Diagnostik der Eisenversorgung bei Anämie chronischer Erkrankungen.
- Management-Systeme (diagnostischer Eisenplot) oder die kombinierte Bestimmung biochemischer Marker (sTfR, Ferritinindex) und hämatologische Indices (%HYPO, Retikulozyten-Hb) ermöglichen die Differenzierung der Eisenmangelanämie von der Anämie chronischer Erkrankungen und der Kombination beider.
- Vor Anordnung einer Eisentherapie bei Patienten mit chronischer Erkrankung und normalem Serumferritin sind die zuvor genannten Untersuchungen hilfreich.
Prof. Dr. med. Lothar Thomas, Dr. med. Gudrun Hintereder
Universitätsklinikum Frankfurt, Zentrum der Inneren Medizin, Zentrallabor, Theodor-Stern Kai 7, 60590 Frankfurt, E-Mail: lothar.thomas@kgu.de
Die Literaturhinweise finden sich in der PDF-Version dieses Artikels.
Multiple Choice-Fragen
Die Multiple Choice-Fragen zu dem Artikel „Eisenmangel bei Anämie und Entzündung: Diagnose und Therapie“ von Prof. Dr. med. Lothar Thomas und Dr. med. Gudrun Hintereder finden Sie im Mitglieder-Portal (https://portal.laekh.de) sowie in der PDF-Version dieses Artikels. Die Teilnahme zur Erlangung von Fortbildungspunkten ist ausschließlich online über das Mitglieder-Portal vom 25. März 2022 bis 24. September 2022 möglich. Die Fortbildung ist mit zwei Punkten zertifiziert. Mit Absenden des Fragebogens bestätigen Sie, dass Sie dieses CME-Modul nicht bereits an anderer Stelle absolviert haben. Dieser Artikel hat ein Peer-Review-Verfahren durchlaufen. Nach Angaben der Autoren sind die Inhalte des Artikels produkt- und/oder dienstleistungsneutral, es bestehen keine Interessenkonflikte.

